题目内容
(6分)铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-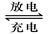 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;当外电路通过1mol电子时,电解液中消耗H2SO4 mol。
(2)充电时,Pb 和电源的 极相连,此时发生的电极反应式为 。
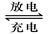 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)(1)放电时:正极的电极反应式是 ;当外电路通过1mol电子时,电解液中消耗H2SO4 mol。
(2)充电时,Pb 和电源的 极相连,此时发生的电极反应式为 。
(1)PbO2+2e-+4H++SO42-=PbSO4+2H2O 1
(2)负 PbSO4+2e-=Pb+SO42-
(2)负 PbSO4+2e-=Pb+SO42-
(1)放电相当于原电池,在原电池中正极得到电子,根据反应式可知,二氧化铅得到电子,所以正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O。根据总反应式可知,每消耗2mol硫酸,反应中就转移2mol电子,所以如果通过1mol电子,则消耗1mol硫酸。
(2)充电相当于放电的逆反应,放电是铅是负极失去电子,所以充电时铅和电源的负极相连,作阴极,得到电子,所以反应式为PbSO4+2e-=Pb+SO42-。
(2)充电相当于放电的逆反应,放电是铅是负极失去电子,所以充电时铅和电源的负极相连,作阴极,得到电子,所以反应式为PbSO4+2e-=Pb+SO42-。

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
 2ZnO,下列判断正确的是( )
2ZnO,下列判断正确的是( ) 2 CO32— + 6H2O,则下列说法错误的是
2 CO32— + 6H2O,则下列说法错误的是
 2PbSO4+2H2O
2PbSO4+2H2O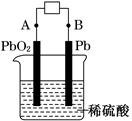
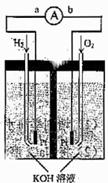
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为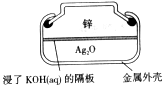
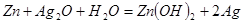
 作负极
作负极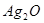 极
极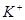 向
向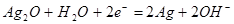
 LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是
LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是 + 12H2O + 14e-;14H2O + 7O2 + 28e-→28OH-,有关推断错误的是( )
+ 12H2O + 14e-;14H2O + 7O2 + 28e-→28OH-,有关推断错误的是( )