题目内容
【题目】(1)写出NaHSO4在水中的电离方程式 _____________________________________。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序是______________________。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为___________。
(4)利用铜制备CuSO4的另一种方法可用化学方程式表示为_______________。
(5)以上两种方法________(填“前”或“后”)者好,原因是________________________。
【答案】 NaHSO4===Na++H++ SO42- ②③①④或③②①④ 2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O Cu+2H2SO4(浓)
2CuSO4+2H2O Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 前 若制得1mol CuSO4,第一种方法只需1mol H2SO4,而第二种方法则要2mol H2SO4,而且生成的SO2又造成大气污染
CuSO4+SO2↑+2H2O 前 若制得1mol CuSO4,第一种方法只需1mol H2SO4,而第二种方法则要2mol H2SO4,而且生成的SO2又造成大气污染
【解析】(1)NaHSO4为强酸酸式盐,在水中完全电离,电离方程式为:NaHSO4=Na++H++SO42-。
(2)除Ca2+用Na2CO3试剂,除Mg2+ 用NaOH试剂,除SO42-用BaCl2试剂,每一步所加试剂必须过量,最后一步除去最后一种加入的过量的试剂。除去这三种杂质离子,有两种方法:方法一是先除去SO42-,然后除去Mg2+,再除去Ca2+,最后除去过量的CO32-,依次加入的试剂为:BaCl2、NaOH、Na2CO3、HCl;方法二是先除去Mg2+,然后除去SO42-,再除去Ca2+,最后除去过量的CO32-,依次加入的试剂为:NaOH、BaCl2、Na2CO3、HCl。故加入试剂的先后顺序为②③①④或③②①④。
(3)在热的稀硫酸溶液中,Cu被空气中的氧气氧化为CuO,CuO与硫酸反应,对应的化学方程式为:2Cu+2H2SO4(稀)+O2 ![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
(4)制备CuSO4的另一种方法是Cu与浓硫酸反应:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(5)比较上述两种方法可知第一种方法没有产生污染物,用的是稀硫酸,生成1molCuSO4只需要消耗1molH2SO4,第二种方法中生成了污染性的气体SO2,且用的是浓硫酸,生成1molCuSO4需要消耗2molH2SO4,故两种方法中前者较好,原因是:若制得1mol CuSO4,第一种方法只需1mol H2SO4,而第二种方法则要2mol H2SO4,而且生成的SO2又造成大气污染。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
气体 | a | b | c | d | |
A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
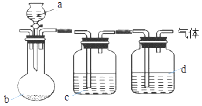
A.A
B.B
C.C
D.D