题目内容
5.6gFe和一定量的稀硝酸恰好完全反应,生成一氧化氮气体,反应后的溶液加入0.25moL的氢氧化钠恰好使铁离子完全沉淀,
(1)则参加反应的硝酸的物质的量为______
(2)写出总反应的离子方程式______.
解:n(Fe)=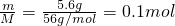 ,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.
,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.
利用十字相乘法计算硝酸铁和硝酸亚铁的物质的量之比.

所以硝酸亚铁与硝酸铁的物质的量之比为0.05mol:0.05mol=1:1.
故铁原子守恒知,有一半的铁生成硝酸亚铁,一半的铁生成硝酸铁.
(1)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
1mol 4mol
0.05mol 0.2mol
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3mol 8mol
0.05mol
所以硝酸的用量为 0.2mol+ =
=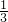 mol,故答案为:
mol,故答案为: ;
;
(2)铁为单质写化学式,一氧化氮是气体写化学式,水是弱电解质写化学式,硝酸、硝酸盐是可溶性强电解质写离子.
故答案为:6Fe+20H++5NO3-═3Fe2++3Fe3++5NO↑+10H2O.
分析:先根据铁与氢氧化钠的物质的量之间的关系判断铁与硝酸反应的生成物,根据铁与硝酸反应的生成物计算硝酸的用量,从而写出相应的离子方程式.
点评:本题考查了硝酸的性质及氧化还原反应的有关计算,如果反应物的物质的量都已知的反应要注意进行过量计算,然后根据不足量的物质计算,要注意稀硝酸有强氧化性,能把铁氧化成最高价态,如果铁有剩余,铁又和三价铁反应生成二价铁.
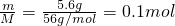 ,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.
,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.利用十字相乘法计算硝酸铁和硝酸亚铁的物质的量之比.

所以硝酸亚铁与硝酸铁的物质的量之比为0.05mol:0.05mol=1:1.
故铁原子守恒知,有一半的铁生成硝酸亚铁,一半的铁生成硝酸铁.
(1)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
1mol 4mol
0.05mol 0.2mol
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3mol 8mol
0.05mol

所以硝酸的用量为 0.2mol+
 =
=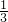 mol,故答案为:
mol,故答案为: ;
;(2)铁为单质写化学式,一氧化氮是气体写化学式,水是弱电解质写化学式,硝酸、硝酸盐是可溶性强电解质写离子.
故答案为:6Fe+20H++5NO3-═3Fe2++3Fe3++5NO↑+10H2O.
分析:先根据铁与氢氧化钠的物质的量之间的关系判断铁与硝酸反应的生成物,根据铁与硝酸反应的生成物计算硝酸的用量,从而写出相应的离子方程式.
点评:本题考查了硝酸的性质及氧化还原反应的有关计算,如果反应物的物质的量都已知的反应要注意进行过量计算,然后根据不足量的物质计算,要注意稀硝酸有强氧化性,能把铁氧化成最高价态,如果铁有剩余,铁又和三价铁反应生成二价铁.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目