题目内容
(9分)A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z同主族,Z与W相邻。请同答:
(1)A2X2的结构式 ,Y2X2的电子式 。
(2)X、Z两种元素的氢化物中熔沸点较高的是 (填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为 。
(3)W元素在周期表中的位置为 ;实验室制备W单质的化学反应方程式为 ;在上述反应中氧化剂和还原剂的物质的量比为 。
(1)A2X2的结构式 ,Y2X2的电子式 。
(2)X、Z两种元素的氢化物中熔沸点较高的是 (填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为 。
(3)W元素在周期表中的位置为 ;实验室制备W单质的化学反应方程式为 ;在上述反应中氧化剂和还原剂的物质的量比为 。
(1)H-O-O-H;
(2)H2O 2SO2+O2 2SO3
2SO3
(3)第三周期第VIIA族 4HCl(浓)+MnO2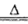 2H2O + Cl2↑+MnCl2;1:2
2H2O + Cl2↑+MnCl2;1:2

(2)H2O 2SO2+O2
 2SO3
2SO3(3)第三周期第VIIA族 4HCl(浓)+MnO2
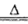 2H2O + Cl2↑+MnCl2;1:2
2H2O + Cl2↑+MnCl2;1:2试题分析:(1)A和X可组成两种常温下为液态的化合物A2X、A2X2,可判断A是H元素,X是O元素;O与Na也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,所以Y是Na;则Z是S元素,W是Cl元素。
(1)A2X2的结构式即过氧化氢的结构式,过氧化氢是共价化合物,其结构式为H-O-O-H;Y2X2是过氧化钠,过氧化钠是离子化合物,电子式为
 ;
;(2)O与S的氢化物中,H2O的沸点较高,因为水分子间存在氢键;Z的低价氧化物是二氧化硫,转化为高价氧化物是三氧化硫,化学方程式为2SO2+O2
 2SO3
2SO3(3)Cl在元素周期表中的位置是第三周期第VIIA族;实验室用浓盐酸与二氧化锰加热制取氯气,化学方程式为4HCl(浓)+MnO2
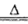 2H2O + Cl2↑+MnCl2;HCl中有1/2作还原剂,二氧化锰作氧化剂,所以该反应中氧化剂与还原剂的物质的量之比是1:2。
2H2O + Cl2↑+MnCl2;HCl中有1/2作还原剂,二氧化锰作氧化剂,所以该反应中氧化剂与还原剂的物质的量之比是1:2。
练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目







