题目内容
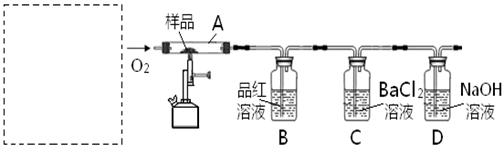
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)已知: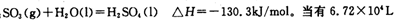 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(2)沸腾炉中发生反应的化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(4)在吸收塔吸收SO3不用水或稀硫酸的原因 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表(a>0):

计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 。(计算结果保留两位小数)

(1)已知:
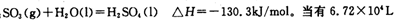 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。(2)沸腾炉中发生反应的化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(4)在吸收塔吸收SO3不用水或稀硫酸的原因 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表(a>0):

计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 。(计算结果保留两位小数)
(1)3.9×105kJ(2分) (2)4FeS2+11O2 4Fe2O3+8SO2(2分)(3)a b d(3分)
4Fe2O3+8SO2(2分)(3)a b d(3分)
(4)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3(2分)
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-(2分) ②14.56(2分)(14.56%不给分)
2.31g(2分)
 4Fe2O3+8SO2(2分)(3)a b d(3分)
4Fe2O3+8SO2(2分)(3)a b d(3分)(4)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3(2分)
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-(2分) ②14.56(2分)(14.56%不给分)
2.31g(2分)
试题分析:(1)根据热化学方程式可知SO3气体与H2O化合时放出的热量为
 ×130.3kJ/mol=3.9×105kJ。
×130.3kJ/mol=3.9×105kJ。(2)黄铁矿燃烧燃烧生成SO2和氧化铁,反应的化学方程式为FeS2+11O2
 4Fe2O3+8SO2。
4Fe2O3+8SO2。(3)生产过程中的矿渣中含有三氧化二铁,可以炼铁,a正确;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率,b正确;催化剂只改变速率不改变平衡,不改变转化率,c不正确;粉碎矿石增大接触面积提高反应速率,d正确,所以正确答案选abd。
(4)由于SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3,所以在吸收塔吸收SO3不用水或稀硫酸。
(5)①单质溴具有氧化性,能把SO2氧化生成硫酸,而溴单质被还原为溴离子,因此反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-。
②从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物;本反应历程是:OH-首先是和NH4HSO3中的H+反应,然后OH-再和NH4+反应放出氨气。由题知铵盐质量为30.00g时,产生0.68g÷17g/mol=0.04molNH3。该铵盐中NH4HSO4先与NaOH溶液反应,2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+H2O,只有当NH4HSO4中的H+消耗完全后,NH4+才能与NaOH溶液反应产生NH3,NH4++OH-=NH3↑+H2O。据此判断铵盐质量为10.00g时NaOH溶液过量,铵盐质量为20.00g和30.00g时,消耗的NaOH质量相等。设10.00g铵盐中NH4HSO4 与(NH4)2SO4的物质的量分别为X、Y,n(NH3)=n(OH-)-n(H+),则有:
| 铵盐质量/g | 10.00 | 20.00 | 30.00 | 40.00 |
| 含NH4HSO4、(NH4)2SO4/mol | X、Y | 2X、2Y | 3X、3Y | 4X、4Y |
| 产生NH3/mol | X+2Y | X+2Y | 0.04 | 0 |
| 消耗NaOH/mol | 2X+2Y | 3X+2Y | 3X+0.04 | 3X+0.04 |
因此3X+2Y=3X+0.04,解得Y=0.02mol,又115X+132Y=10.00,得X=0.064mol.则该铵盐中氮元素的质量分数=
 ×100%=14.56%。
×100%=14.56%。由上面讨论可知此NaOH溶液中共有0.232molNaOH,当铵盐质量为15.00g时含0.096mol NH4HSO4和0.03mol (NH4)2SO4,共有NH4+和H+ 0.252mol,故NaOH不足,此时产生n(NH3)=(0.232-0.096)mol=0.136mol,因此NH3的质量=0.136mol×17g/mol=2.31g。

练习册系列答案
相关题目
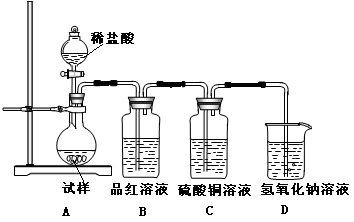

 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。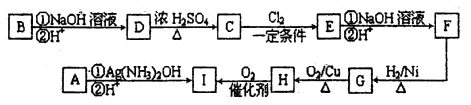
 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4