题目内容
【题目】(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH﹣)=1×10﹣20的溶液,其pH为 ,此时水的电离受到 .
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2·L﹣2,则该温度下:100mL 0.1mol·L﹣1H2SO4溶液与100mL 0.4mol·L﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣,下列分析结果肯定错误的是 .
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a mol·L﹣1的氨水与0.01mol·L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:HClO:Ka=3×10﹣8;H2CO3:Ka1=4.3×10﹣7;Ka2=5.6×10﹣11;84消毒液中通入少量的CO2,该反应的化学方程式为 .
【答案】(1)4或10;抑制;
(2)12;(3)C;
(4)中;![]() ;
;
(5)NaClO+CO2+H2O═HClO+NaHCO3
【解析】
试题分析:(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH﹣)=1×10﹣20的溶液,水电离的c(H+)=c(OH﹣)=1×10﹣10,抑制水电离;若是碱溶液,其pH为10;若是酸溶液其pH为=4.
(2)100mL 0.1mol·L﹣1H2SO4溶液与100mL 0.4mol·L﹣1的KOH溶液混合后,氢氧化钾有剩余,![]() 0.1 mol·L﹣1,
0.1 mol·L﹣1,![]() ,pH=12.
,pH=12.
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣,根据电荷守恒,c(H+)>c(Y﹣)>c(X+)>c(OH﹣)不符合电荷守恒,肯定错误.
(4)在25℃下,将a mol·L﹣1的氨水与0.01mol·L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).根据电荷守恒,c(NH4+)+ c(H+)=c(Cl﹣)+c(OH-),则溶液显中性;该溶液![]() ; c(NH4+)=c(Cl﹣)=0.005mol·L﹣1,根据物料守恒c(NH4+)+ c(
; c(NH4+)=c(Cl﹣)=0.005mol·L﹣1,根据物料守恒c(NH4+)+ c(![]() )=
)=![]() mol·L﹣1,c(
mol·L﹣1,c(![]() ) =
) =![]() mol·L﹣1-0.005mol·L﹣1。用含a的代数式表示NH3·H2O的电离常数Kb =
mol·L﹣1-0.005mol·L﹣1。用含a的代数式表示NH3·H2O的电离常数Kb = 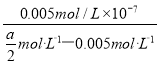 =
= ![]() .
.
(5)HClO:Ka=3×10﹣8;H2CO3:Ka1=4.3×10﹣7;Ka2=5.6×10﹣11;84消毒液中通入少量的CO2,该反应的化学方程式为NaClO+CO2+H2O═HClO+NaHCO3。