题目内容
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:
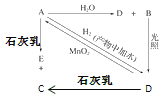
(1)请分别写出下列物质的化学式(如为溶液请填溶质的化学式):
A________、B________、D________。
(2)写出下列反应的化学方程式或离子方程式(请注明反应条件):
A+H2O(离子方程式):_____________;
A+石灰乳(化学方程式):______________;
E露置在空气中的第1个化学方程式:___________。
(3)漂白粉的有效成分是________(化学名称),保存漂白粉的方法__________、______________。
【答案】Cl2 HClO HCl Cl2+H2O=H++Cl-+HClO 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 次氯酸钙 密封 干燥避光、冷暗处
【解析】
由A是可用来对自来水进行消毒的黄绿色单质气体,可知A为Cl2,Cl2与H2O反应生成HCl和HClO,HClO化学性质不稳定,光照条件下会分解为HCl和O2,由此可知,B为HClO,D为HCl,Cl2与石灰乳反应生成Ca(ClO)2、CaCl2、H2O,HCl与石灰乳反应会生成CaCl2和H2O,因H2O在图中存在分子式,故C不是H2O,由此可知,C为CaCl2,E为Ca(ClO)2,以此解答本题。
(1)由上述分析可知,A为Cl2;B为HClO;D为HCl;
(2)Cl2与H2O反应生成HCl和HClO,其离子方程式为:Cl2+H2O=H++Cl-+HClO;
Cl2与石灰乳反应生成Ca(ClO)2、CaCl2、H2O,其化学反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
Ca(ClO)2暴露在空气中会与空气中二氧化碳反应而变质,其反应的化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;
(3)漂白粉的有效成分为次氯酸钙;因次氯酸钙会与空气中二氧化碳反应生成次氯酸,而次氯酸见光受热易分解生成氯化氢和氧气,氯化氢与碳酸钙反应生成氯化钙、二氧化碳、水,从而使漂白粉最终变质为氯化钙,从而失去漂白效果,因此漂白粉需保存在干燥避光、冷暗处。