题目内容
按要求完成下列填空:(1)已知在标准状况下的四种气体 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3用相应的序号填写下列空白:
体积最大的是______;质量最小的是______;含氢原子数最多的是______.
(2)等物质的量的氧气与臭氧质量之比为______,分子个数之比为______,氧原子个数之比为______.
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl-.则金属M的摩尔质量为______.
(4)现有10克由2H和16O组成的水分子,其中含质子数为______mol,中子数为______mol.
【答案】分析:(1)根据n= =
=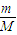 =
= 计算相关物理量;
计算相关物理量;
(2)根据N=nNA结合分子、原子构成计算;
(3)根据n=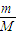 结合物质的构成计算;
结合物质的构成计算;
(4)根据n= 结合原子构成计算.
结合原子构成计算.
解答:解:(1)6.72L CH4:n(CH4)=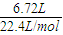 =0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,N(H)=0.3×4NA=1.2NA;
=0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,N(H)=0.3×4NA=1.2NA;
3.01×1023个HCl分子:n(HCl)= =0.5mol,V(HCl)=0.5mol×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=0.5NA;
=0.5mol,V(HCl)=0.5mol×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=0.5NA;
13.6克H2S:n(H2S)=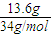 =0.4mol,V(H2S)=0.4mol×22.4L/mol=8.96L,N(H)=0.8NA;
=0.4mol,V(H2S)=0.4mol×22.4L/mol=8.96L,N(H)=0.8NA;
0.2molNH3:V(NH3)=0.2mol×22.4L/mol=4.48L,m(NH3)=0.2mol×17g/mol=3.4g,N(H)=0.2×3NA=0.6NA;
则体积最大的是②;质量最小的是④;含氢原子数最多的是①,
故答案为:②;④;①;
(2)等物质的量的氧气与臭氧,二者的摩尔质量分别为32g/mol、48g/mol,分子式分别为O2、O3,由n=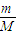 可知,
可知,
质量之比为2:3,由N=nNA可知,分子个数之比为1:1,氧原子个数之比为2:3,
故答案为:2:3;1:1;2:3;
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl-,则M3+为0.200mol,m(M3+)=26.7g-0.600mol×35.5g/mol=5.4g,则金属M的摩尔质量为 =27g/mol,
=27g/mol,
故答案为:27g/mol;
(4)10克由2H和16O组成的水分子,其中含质子为 ×(2×1+8)=5mol,中子为
×(2×1+8)=5mol,中子为 ×(2×1+8)=5mol,
×(2×1+8)=5mol,
故答案为:5;5.
点评:本题考查物质的量的相关计算,题目难度不大,解答本题的关键是在学习中注意相关计算公式的运用,能把握相关物质的原子结构.
 =
=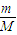 =
= 计算相关物理量;
计算相关物理量;(2)根据N=nNA结合分子、原子构成计算;
(3)根据n=
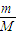 结合物质的构成计算;
结合物质的构成计算;(4)根据n=
 结合原子构成计算.
结合原子构成计算.解答:解:(1)6.72L CH4:n(CH4)=
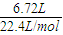 =0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,N(H)=0.3×4NA=1.2NA;
=0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,N(H)=0.3×4NA=1.2NA;3.01×1023个HCl分子:n(HCl)=
 =0.5mol,V(HCl)=0.5mol×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=0.5NA;
=0.5mol,V(HCl)=0.5mol×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=0.5NA;13.6克H2S:n(H2S)=
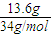 =0.4mol,V(H2S)=0.4mol×22.4L/mol=8.96L,N(H)=0.8NA;
=0.4mol,V(H2S)=0.4mol×22.4L/mol=8.96L,N(H)=0.8NA;0.2molNH3:V(NH3)=0.2mol×22.4L/mol=4.48L,m(NH3)=0.2mol×17g/mol=3.4g,N(H)=0.2×3NA=0.6NA;
则体积最大的是②;质量最小的是④;含氢原子数最多的是①,
故答案为:②;④;①;
(2)等物质的量的氧气与臭氧,二者的摩尔质量分别为32g/mol、48g/mol,分子式分别为O2、O3,由n=
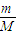 可知,
可知,质量之比为2:3,由N=nNA可知,分子个数之比为1:1,氧原子个数之比为2:3,
故答案为:2:3;1:1;2:3;
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl-,则M3+为0.200mol,m(M3+)=26.7g-0.600mol×35.5g/mol=5.4g,则金属M的摩尔质量为
 =27g/mol,
=27g/mol,故答案为:27g/mol;
(4)10克由2H和16O组成的水分子,其中含质子为
 ×(2×1+8)=5mol,中子为
×(2×1+8)=5mol,中子为 ×(2×1+8)=5mol,
×(2×1+8)=5mol,故答案为:5;5.
点评:本题考查物质的量的相关计算,题目难度不大,解答本题的关键是在学习中注意相关计算公式的运用,能把握相关物质的原子结构.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目