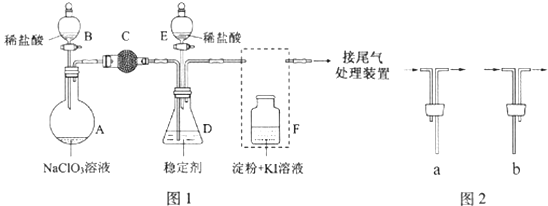
题目内容
【题目】标准状况下,现有①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3,对这四种气体的关系有以下四种表述,其中不正确的是
A.体积:②>③>①>④ B.物质的量:②>③>④>①
C.质量:②>③>①>④ D.氢原子个数:①>③>④>②
【答案】B
【解析】根据相关计算关系即可得下表:
CH4 | HCl | H2S | NH3 | |
体积 | 6.72 L | 11.2 L | 8.96 L | 4.48 L |
物质的量 | 0.3 mol | 0.5 mol | 0.4 mol | 0.2 mol |
质量 | 4.8 g | 18.25 g | 13.6 g | 3.4 g |
氢原子数 | 1.2NA | 0.5NA | 0.8NA | 0.6NA |
可知A、C、D正确。

练习册系列答案
相关题目
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .