题目内容
某铝合金中含有镁、铜、硅,为了测定研究它的抗腐蚀性能和测定合金中铝的含量,某研究性学习小组设计了如下实验:
(一)探究铝合金的抗腐蚀性能
①向一只小烧杯里加入20mL0.5mol/LCuSO4溶液,把一小块铝合金浸入溶液中,1~2分钟后将铝片取出,观察铝片表面的现象
②取1只试管,加入10mL2mol/LNaOH溶液,将一块铝片放入NaOH溶液里,片刻取出后,用蒸馏水冲洗后浸入CuSO4溶液里.1~2分钟后将铝片取出,观察铝片表面的现象
实验①铝片没有变化,实验②铝片表面的现象是______
发生此现象的原因是______
(二)测定铝合金中的铝的百分含量
①取该样品a克,将样品溶于足量的稀盐酸中,过滤;
②在滤液中加入过量的氢氧化钠溶液,过滤;
③往第②步的滤液中通入足量的CO2,过滤,将沉淀用蒸馏水洗涤后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b克.
回答下列问题:
(1)在第①步操作中溶解所使用的玻璃仪器为玻璃棒、______,滤液中主要含有Mg2+、Na+、______和Cl-离子;
(2)在第②步操作中氢氧化钠溶液需要过量的原因是______,写出该步骤中生成沉淀的离子方程式______
(3)第③步灼烧过程中可在下列哪种仪器中进行______
A.烧杯 B.试管 C.坩埚 D.蒸发皿
(4)第③步灼烧后得到的固体是______
(5)合金中铝的质量分数是______.
解:(一)根据铝表面有一层致密的氧化物,该氧化物与CuSO4 溶液不反应,氢氧化钠溶液能除去表面的氧化膜:
Al2O3+2NaOH=NaAlO2+2H2O,内层的铝与硫酸铜发生置换反应生成金属铜:2Al+3CuSO4=Al2(SO4)3+3Cu,铜的颜色为红色;故答案为:铝片表面有亮红色的固体附着;因为铝片有一层致密的氧化物保护膜,可以阻止内部的金属铝与CuSO4反应,当铝片事先放入氢氧化钠溶液后,这层氧化膜被破坏,金属铝与硫酸铜发生置换反应生成了金属铜. (二)(1)因溶解需要的仪器有:烧杯、玻璃棒;将样品溶于足量的稀盐酸中,铜、硅与盐酸不反应,镁和铝与盐酸反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,过滤除去铜、硅,由于盐酸足量,所以,滤液中的成分为:
MgCl2、AlCl3、HCl,滤液中主要含有Mg2+、Na+、Al3+ 和Cl-离子;故答案为:烧杯;Al3+;
(2)因过量的氢氧化钠溶液发生的反应有:HCl+NaOH=NaCl+H2O,2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,实现了和 Mg(OH)2沉淀的分离,
故答案为:使Al3+全部变成AlO2-离子; Mg2++2OH-=Mg(OH)2↓;
(3)因灼烧过程中需要的仪器有:坩埚、坩埚 钳、酒精灯、泥三角、三脚架等,故答案为:C.
(4)因滤液中含有NaAlO2,通入足量的CO2发生反应:NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓,沉淀为Al(OH)3,灼烧时发生反应:2Al(OH)3 Al2O3+3H2O;故答案为:Al2O3; (5)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
Al2O3+3H2O;故答案为:Al2O3; (5)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
bg× =
=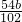 g,所以样品中铝的质量分数为:
g,所以样品中铝的质量分数为: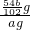 ×100%=
×100%=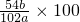 %,
%,
故答案为: ×100%.
×100%.
分析:(一)因铝表面有一层致密的氧化物,该氧化物与CuSO4溶液不反应,若用氢氧化钠除去表面的氧化膜,内层的铝与硫酸铜发生置换反应生成金属铜;
(二)(1)根据溶解所需要的玻璃仪器;根据滤液的成分;
(2)根据过量的碱与Al3+反应生成AlO2-;根据Mg2+与OH-反应;
(3)根据灼烧所需要的仪器;
(4)根据偏铝酸钠与足量的CO2反应生成氢氧化铝沉淀,氢氧化铝不稳定加热易分解;
(5)根据铝守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,最后求出铝的质量分数.
点评:对于NaAlO2与CO2的化学反应方程式,有过量和少量之分,书写时注意区分.
Al2O3+2NaOH=NaAlO2+2H2O,内层的铝与硫酸铜发生置换反应生成金属铜:2Al+3CuSO4=Al2(SO4)3+3Cu,铜的颜色为红色;故答案为:铝片表面有亮红色的固体附着;因为铝片有一层致密的氧化物保护膜,可以阻止内部的金属铝与CuSO4反应,当铝片事先放入氢氧化钠溶液后,这层氧化膜被破坏,金属铝与硫酸铜发生置换反应生成了金属铜. (二)(1)因溶解需要的仪器有:烧杯、玻璃棒;将样品溶于足量的稀盐酸中,铜、硅与盐酸不反应,镁和铝与盐酸反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,过滤除去铜、硅,由于盐酸足量,所以,滤液中的成分为:
MgCl2、AlCl3、HCl,滤液中主要含有Mg2+、Na+、Al3+ 和Cl-离子;故答案为:烧杯;Al3+;
(2)因过量的氢氧化钠溶液发生的反应有:HCl+NaOH=NaCl+H2O,2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,实现了和 Mg(OH)2沉淀的分离,
故答案为:使Al3+全部变成AlO2-离子; Mg2++2OH-=Mg(OH)2↓;
(3)因灼烧过程中需要的仪器有:坩埚、坩埚 钳、酒精灯、泥三角、三脚架等,故答案为:C.
(4)因滤液中含有NaAlO2,通入足量的CO2发生反应:NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓,沉淀为Al(OH)3,灼烧时发生反应:2Al(OH)3
 Al2O3+3H2O;故答案为:Al2O3; (5)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
Al2O3+3H2O;故答案为:Al2O3; (5)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为bg×
 =
=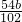 g,所以样品中铝的质量分数为:
g,所以样品中铝的质量分数为: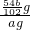 ×100%=
×100%=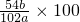 %,
%,故答案为:
 ×100%.
×100%.分析:(一)因铝表面有一层致密的氧化物,该氧化物与CuSO4溶液不反应,若用氢氧化钠除去表面的氧化膜,内层的铝与硫酸铜发生置换反应生成金属铜;
(二)(1)根据溶解所需要的玻璃仪器;根据滤液的成分;
(2)根据过量的碱与Al3+反应生成AlO2-;根据Mg2+与OH-反应;
(3)根据灼烧所需要的仪器;
(4)根据偏铝酸钠与足量的CO2反应生成氢氧化铝沉淀,氢氧化铝不稳定加热易分解;
(5)根据铝守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,最后求出铝的质量分数.
点评:对于NaAlO2与CO2的化学反应方程式,有过量和少量之分,书写时注意区分.

练习册系列答案
相关题目