题目内容
我校化学兴趣小组的学生对某品牌的消毒液的成分和性质进行实验探究:
①该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸);
②用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色;
③取适量消毒液,滴加稀硫酸后,有黄绿色气体生成;
④用洁净铂丝蘸取消毒液,在无色灯焰上灼烧,火焰呈黄色。
⑤取适量消毒液,通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。
请回答以下问题:
(1)该消毒液的主要成分是_______________________________________。
(2)pH试纸颜色的变化说明消毒液溶液具有的性质是 _________________。
(3)实验③中的离子方程式为_______________________________________。
(4)实验⑤中,有“浅黄色沉淀”生成时的离子方程式为_________________________,又“澄清”时的离子方程式为__________________________________________。
(1)NaCl和NaClO;
(2)碱性,漂白性;
(3)Cl-+ClO-+2H+=Cl2↑+H2O
(4)H2S+ClO-=S↓+Cl-+H2O;S+3ClO-+2OH-=SO42-+3Cl-+H2O(或S+3ClO-+H2O=SO42-+3Cl-+2H+)
【解析】
试题分析:该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸),证明含有Cl-;用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色,证明溶液呈碱性、有氧化性;消毒液滴加稀硫酸后,有黄绿色气体生成,证明有氧化性的微粒是ClO-;该消毒液焰色反应呈黄色,说明含Na+;向该消毒液中通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。说明先生成不溶于水的S单质,然后S单质又被氧化成SO42-。得到既不溶于水也不溶于酸的BaSO4沉淀。
考点:考查离子的鉴定、离子共存、有离子参加的氧化还原反应等知识。

(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
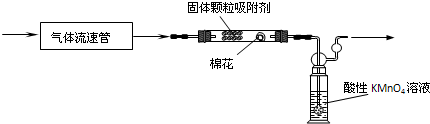
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 ▲ g/L
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)每隔一定时间测定其pH,数据如表Ⅰ所示.
(3)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
表Ⅰ不同时间酸雨的pH
| 测定时间/小时钟 | 1 | 2 | 4 | |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(2)生成白色浑浊的化学方程式______.
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示):______.
第二组,用拟用下列装置定量分析空气中SO2的含量:
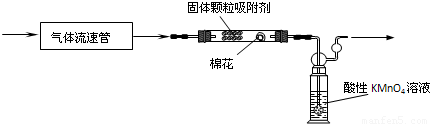
(4)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的化学方程式:5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+K2SO4.
该反应的现象是______
(5)KMnO4溶液中导管末端做成球状多孔结构的作用是______.
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为______g/L.