题目内容
(1)①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
(2)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为 ;
②所得溶液中Cl-的物质的量为 mol。
(1)①32 g·mol-1 ② ×29
×29
(2)①10.7% ②0.25
【解析】(1)①1个RO42-中核外电子总数比质子总数多2个,则0.5 mol RO42-核外电子总数比质子总数多1 mol,则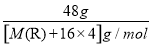 =0.5 mol M(R)=32 g·mol-1。
=0.5 mol M(R)=32 g·mol-1。
②由题意知,该瓶中空气质量为(M2-M1)g,气体A的质量为(M3-M1)g,由阿伏加德罗定律知,两气体的物质的量相等,即
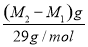 =
=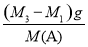
M(A)= ×29。
×29。
(2)①根据c= ,得w=
,得w=
= ×100%≈10.7%
×100%≈10.7%
②根据钠原子守恒可知n(NaCl)+n(NaClO)=n(NaOH)=0.100 L×3.00 mol·L-1=0.300 mol,则n(NaCl)=0.300 mol-0.050 0 mol=0.25 mol,则n(Cl-)=0.25 mol。

 名校课堂系列答案
名校课堂系列答案下列每组分别给出了两个量,其中可以求出物质的量的有( )。
① | ② | ③ | ④ | ⑤ |
物质所含的微粒数 | 固体体积 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A.①②⑤ B.②③④ C.①④⑤ D.①③④