题目内容
(2010?唐山三模)如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用).请根据下列要求回答问题.
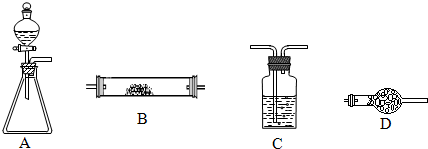
(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,则:
当仪器连接顺序为A→C→C→B→D时,B装置中为铝粉,制备少量无水三氯化铝.A中发生反应的化学方程式
(2)若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母)
(3)若锥形瓶中为大理石,分液漏斗中为稀盐酸,B装置中为镁粉,为验证镁与二氧化碳的反应,仪器的连接顺序为A→C→C→B,第一个装置中的试剂名称为
(4)若锥形瓶中为二氧化锰固体,分液漏斗中为双氧水,B装置中为电石(只含杂质硫化钙),仪器的连接顺序为A→C→B→C→C,第二个C装置中为品红溶液,第三个C装置中为澄清石灰水,且实验后品红溶液红色明显变浅,澄清石灰水变浑浊,写出B中发生的可能反应

(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,则:
当仪器连接顺序为A→C→C→B→D时,B装置中为铝粉,制备少量无水三氯化铝.A中发生反应的化学方程式
4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
,第二个C装置中盛装的试剂为浓硫酸
浓硫酸
,D装置的作用是除去尾气氯气,并防止空气中的水进入B装置
除去尾气氯气,并防止空气中的水进入B装置
.(2)若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母)
A
A
→D
D
→B
B
→D
D
;装置B中可能观察到的现象是B装置中有红棕色气体出现
B装置中有红棕色气体出现
.(3)若锥形瓶中为大理石,分液漏斗中为稀盐酸,B装置中为镁粉,为验证镁与二氧化碳的反应,仪器的连接顺序为A→C→C→B,第一个装置中的试剂名称为
饱和NaHCO3溶液
饱和NaHCO3溶液
,B中发生反应的化学方程式为2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,在加热B装置之前,应该
| ||
打开分液漏斗的活塞,先通一段时间的二氧化碳
打开分液漏斗的活塞,先通一段时间的二氧化碳
.(4)若锥形瓶中为二氧化锰固体,分液漏斗中为双氧水,B装置中为电石(只含杂质硫化钙),仪器的连接顺序为A→C→B→C→C,第二个C装置中为品红溶液,第三个C装置中为澄清石灰水,且实验后品红溶液红色明显变浅,澄清石灰水变浑浊,写出B中发生的可能反应
2CaC2+5O2
2CaO+4CO2
| ||
2CaC2+5O2
2CaO+4CO2
,
| ||
2CaS+3O2
2CaO+2SO2
| ||
2CaS+3O2
2CaO+2SO2
.若反应前B中样品质量为8.40g,反应后B中残留固体质量为7.28g,则电石中碳化钙的质量分数为
| ||
91.4%
91.4%
.(假设固体反应完全,结果保留三位有效数字).分析:(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,二者发生反应制备氯气,经除杂、干燥后与Al在B中反应生成氯化铝,氯气有毒,应有尾气处理装置;
(2)过氧化钠与水反应生成氧气,与氨气经干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应;
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体可用品红和澄清石灰水检验.
(2)过氧化钠与水反应生成氧气,与氨气经干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应;
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体可用品红和澄清石灰水检验.
解答:解:(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,二者发生反应制备氯气,反应的化学方程式为4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O,先用饱和食盐水除去HCl,再经过浓硫酸干燥,然后与Al在B中反应生成氯化铝,氯气有毒,应有尾气处理装置,
故答案为:4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O;浓硫酸;除去尾气氯气,并防止空气中的水进入B装置;
(2)过氧化钠与水反应生成氧气,与氨气经盛有碱石灰的干燥管干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理,则连接顺序为A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液),NO和氧气反应生成红棕色的二氧化氮气体,在B中可观察到红棕色,
故答案为:A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液);B装置中有红棕色气体出现;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应:2Mg+CO2
2MgO+C,为防止空气中氧气和氮气与镁反应,应先通入二氧化碳将空气排出,
故答案为:饱和NaHCO3溶液;2Mg+CO2
2MgO+C;打开分液漏斗的活塞,先通一段时间的二氧化碳;
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体,发生反应分别为2CaC2+5O2
2CaO+4CO2;2CaS+3O2
2CaO+2SO2,可用品红和澄清石灰水检验,
若反应前B中样品质量为8.40g,反应后B中残留固体质量为7.28g,设CaC2为xmol,CaS为ymol,则
解得x=0.12mol,
则m(CaC2)=0.17mol×64g/mol=7.68g,
ω(CaC2)=
×100%=91.4%,
故答案为:2CaC2+5O2
2CaO+4CO2;2CaS+3O2
2CaO+2SO2;91.4%.
故答案为:4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O;浓硫酸;除去尾气氯气,并防止空气中的水进入B装置;
(2)过氧化钠与水反应生成氧气,与氨气经盛有碱石灰的干燥管干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理,则连接顺序为A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液),NO和氧气反应生成红棕色的二氧化氮气体,在B中可观察到红棕色,
故答案为:A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液);B装置中有红棕色气体出现;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应:2Mg+CO2
| ||
故答案为:饱和NaHCO3溶液;2Mg+CO2
| ||
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体,发生反应分别为2CaC2+5O2
| ||
| ||
若反应前B中样品质量为8.40g,反应后B中残留固体质量为7.28g,设CaC2为xmol,CaS为ymol,则
|
解得x=0.12mol,
则m(CaC2)=0.17mol×64g/mol=7.68g,
ω(CaC2)=
| 7.68 |
| 8.40 |
故答案为:2CaC2+5O2
| ||
| ||
点评:本题考查较为综合,涉及物质的制备、除杂以及性质检验等知识,题目难度中等,注意把握实验方法和步骤.

练习册系列答案
相关题目
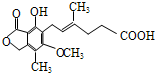 (2010?唐山三模)霉酚酸(Mycophenolic acid) 是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )
(2010?唐山三模)霉酚酸(Mycophenolic acid) 是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )