题目内容
17.把足量镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是( )①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④加入少量的CuSO4溶液.
| A. | 只有①② | B. | 只有③④ | C. | ①②③④ | D. | 只有①②③ |
分析 该反应中,氢离子浓度、反应物接触面积、温度等都影响化学反应速率,据此分析解答.
解答 解:①盐酸的浓度越大,单位体积内活化分子数越多,反应速率越快,故正确;
②镁带的表面积越大,反应物接触面积越大,反应速率越快,故正确;
③溶液的温度越高,活化分子百分数越大,则反应速率越快,故正确;
④加入少量的CuSO4溶液,Mg置换出Cu,Mg、Cu和稀盐酸构成原电池,加快反应速率,故正确;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率影响原理是解本题关键,注意原电池加快反应速率,所以用锌和稀硫酸制取氢气时用粗锌而不是纯锌,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列事实不能用勒夏特列原理解释的是( )
| A. | 用浓氨水和氢氧化钠制取氨气 | |
| B. | 加热蒸干AlCl3溶液不能得到无水AlCl3 | |
| C. | 工业上SO2和O2在常压下生成SO3 | |
| D. | 水中的c(H+)比0.1mol/LNaOH溶液中的c(H+)大 |
5.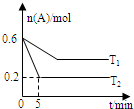 一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )
一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )
 一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )
一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )| A. | 正反应△H>0 | |
| B. | 平衡常数K(T2)<K(T1) | |
| C. | T2时,达到平衡时A的转化率为33.3% | |
| D. | T2时,该反应的化学平衡常数为0.8 |
2.下列物质中,属于电解质的是( )
| A. | CO2 | B. | 乙醇 | C. | CaCO3 | D. | 铜 |
9.设NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| B. | 在标准状况下,11.2L H2O含有水分子的个数为NA | |
| C. | 16g臭氧(O3)中含有氧原子的个数为NA | |
| D. | 1L 1mol/L NaCl溶液中含有Na+的个数为NA |
7.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白,过氧化氢法生产亚氯酸钠的流程图如图所示.已知NaClO3的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O且NaClO2在碱性条件下稳定性较高,试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号)
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当PH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O.
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
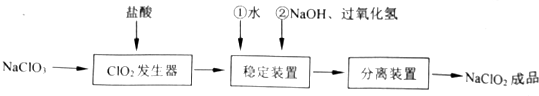
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号)
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当PH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).

 (1)键线式:
(1)键线式: 表示的分子式C6H14,名称是2-甲基戊烷;
表示的分子式C6H14,名称是2-甲基戊烷;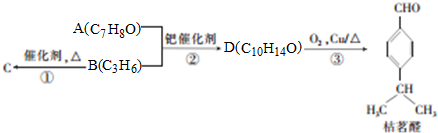
 .
.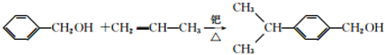 .
.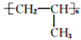 .
. .
.

 .
. .
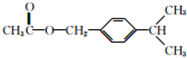
. (写结构简式).
(写结构简式). (写结构简式).
(写结构简式).