题目内容
利用反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH =+746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH =+746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
B
【解析】降低温度,反应速率减慢,且平衡左移,NO转化率降低,A错;由平衡移动原理知,增大压强平衡右移,NO转化率增大,反应速率加快,加催化剂反应速率也加快,B选项正确;升高温度平衡右移,但是同时充入N2平衡左移,无法确定最终平衡向哪个方向移动;及时将CO2和N2从反应体系中移走,平衡右移,NO的转化率增大,但是反应的速率减小。

在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中发生下述反应:PCl3(g)+Cl2(g) PCl5(g),5 min末达到平衡,有关数据如表。
PCl5(g),5 min末达到平衡,有关数据如表。
| PCl3(g) | Cl2(g) | PCl5(g) |
初始浓度(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5 min内,v(PCl3)=0.08 mol·L-1·min-1
C.当容器中Cl2为1.2 mol时,可逆反应达到平衡状态
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
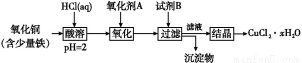
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
(2)如图立方体中心的“”表示硅晶体中的一个原子,请在立方体的顶点用“”表示出与之紧邻的硅原子。

(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。