题目内容
【题目】某同学设计了如下装置用于制取 SO2 和验证 SO2 的性质。
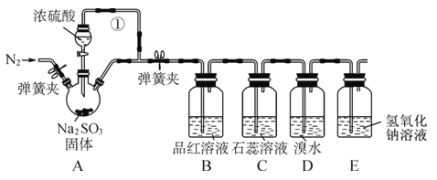
试回答以下问题:
(1)装置 A 中反应的化学方程式为___________________________________。
(2)导管①的作用是___________________,最左侧通N2的主要作用是___________________
(3)装置 B 中的现象体现出 SO2 _______________性。
(4)装置 D 中溴水褪色,体现出 SO2 _________________性。
(5)E 装置的作用是 ______________,发生反应的离子方程式为_____________________。
【答案】H2SO4 + Na2SO3 = Na2SO4 + SO2↑ + H2O 平衡气压,便于浓硫酸顺利滴下 载气 漂白 还原 吸收SO2气体,防止污染空气 2OH—+ SO2 = SO32—+ H2O(或OH—+ SO2 = HSO3—)
【解析】
亚硫酸钠(Na2SO3)固体与较浓硫酸(H2SO4)在装置A中发生反应,生成二氧化硫,二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,所以实验过程中,品红试液的颜色变为无色,二氧化硫和水反应生成亚硫酸,石蕊试液遇酸显红色,SO2通入溴水中,溴水褪色是因为SO2具有还原性,与Br2发生氧化还原反应,二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,据此答题,
(1)亚硫酸钠(Na2SO3)固体与浓硫酸(H2SO4)在装置A中发生反应,生成硫酸钠、水和二氧化硫,化学反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑ +H2O,
故答案为:H2SO4+Na2SO3=Na2SO4+SO2↑ +H2O。
(2)导管①用橡皮管连接分液漏斗,能平衡分液漏斗内压强,使浓硫酸能够顺利流下;氧气能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,故答案为:平衡气压,便于浓硫酸顺利滴下;载气。
(3)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,所以实验过程中,品红试液的颜色变为无色,故答案为:漂白性。
(4)SO2通入溴水中,溴水褪色是因为SO2具有还原性,与Br2发生氧化还原反应,反应的化学方程式SO2+Br2+2H2O=H2SO4+2HBr,故答案为:还原性。
二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,因此装置D作为尾气吸收之用,SO2是酸性氧化物,和氢氧化钠反应生成亚硫酸钠(或亚硫酸氢钠)和水,离子方程式为:2OH-+SO2=SO32-+H2O或OH-+SO2=HSO3-,
故答案为:吸收SO2气体,防止污染空气;2OH-+SO2=SO32-+H2O或OH-+SO2=HSO3-。