题目内容
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)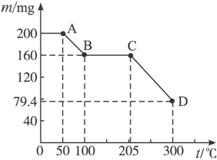
试回答下列问题:
(1)写出B点固体产物的化学式__________________;
(2)从B点到C点过程中固体物质质量不变的原因是____________________________;
(3)通过计算确定D点处产物的相对分子质量,并推断其合理的化学式。
(1)MnC2O4
(2)说明MnC2O4在100—205 ℃之间较稳定
(3)D点产物的相对分子质量为71,化学式为MnO
解析:至A点晶体只受热,A→B点,晶体受热失去结晶水;B→C,MnC2O4只受热,升高温度,还未达到分解温度,C→D,MnC2O4受热分解。带结晶水的化合物在加热分解时往往先失掉结晶水再分解。

 阅读快车系列答案
阅读快车系列答案营养成分平均含量(每100 mL) 脂肪 蛋白质 糖类 钙200 mg 非脂乳固体 配料:脱脂奶、鲜牛奶、稳定剂、碳酸钙 |
某种品牌牛奶的营养成分表(部分)
(1)计算该牛奶一盒(250 mL)中所含蛋白质的质量是多少?
(2)一个体重
(3)已知蛋白质在体内氧化所释放的热量约占总热量的10%—15%,试问该成年人每天至少摄取多少克淀粉,方可满足生理需求,维持膳食平衡?
某种品牌牛奶的营养成分表(部分)
营养成分平均含量(每100 mL) 脂肪 13. g 蛋白质 3.6 g 糖类 5.7 g 钙 200 mg 非脂乳固体 9.5 g 配料:脱脂奶、鲜牛奶、稳定剂、碳酸钙 |
(1)计算该一盒(250 mL)牛奶中所含蛋白质的质量是多少。
(2)一个体重60 kg 的成年人,每天需补充70~105 g 蛋白质,如果该成年人以该种牛奶来维持蛋白质的需求,每天需饮用这种牛奶的体积最少是多少?
(3)已知淀粉在体内氧化所释放的热量约占总热量的60%~70%,试问该成年人每天至少摄取多少克淀粉,方可满足生理需求,维持膳食平衡?
下图所示是一种牛奶的营养成分表。
|
营养成分平均含量(每100 mL) 脂肪 1.3 g 蛋白质 3.6 g 糖类 5.7 g 钙 200 mg 非脂乳固体 9.5 g 配料:脱脂奶、鲜牛奶、稳定剂、碳酸钙 |
(1)计算该牛奶一盒(250 mL)中所含蛋白质的质量是多少?
(2)一个体重60 kg的成年人,每天需要补充70~105 g蛋白质,如果该成年人以该种牛奶来维持蛋白质的需求,每天需饮用这种牛奶的体积最少是多少?
(3)已知蛋白质、淀粉在体内氧化所释放的热量分别约占总热量的10%~15%、60%~70%,1 g蛋白质与1 g淀粉在体内氧化时大约均可产生16.7 kJ热能,试问该成年人每天至少摄取多少克淀粉方可满足生理需求,维持膳食平衡?
