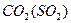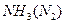题目内容
两位同学设计了如下两个方案,并都认为,如果观察到的现象和设计的方案一致,即能证明试液中有SO42-。
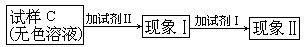
方案甲:某待测液中滴加BaCl2溶液,产生白色沉淀,滴加足量稀盐酸,白色沉淀不溶解。
方案乙:某待测液中滴加足量稀盐酸,无沉淀,再滴加BaCl2溶液,产生白色沉淀。
试评价上述各种方案是否严密,并分析说明理由。
方案甲:某待测液中滴加BaCl2溶液,产生白色沉淀,滴加足量稀盐酸,白色沉淀不溶解。
方案乙:某待测液中滴加足量稀盐酸,无沉淀,再滴加BaCl2溶液,产生白色沉淀。
试评价上述各种方案是否严密,并分析说明理由。
甲方案不严密,因为溶液可能为含有Ag+而不含SO42-的无色溶液,当加入BaCl2溶液时同样可生成白色沉淀:Ag++ Cl-=AgCl↓,再加稀硝酸,AgCl也不溶解,故方案甲不严密;乙方案严密,因为只有含SO42-的无色溶液才会出现此方案的现象。
本题考查SO42的检验。SO42-的检验,所用试剂为BaCl2或Ba(NO3)2及盐酸,所以必须注意Ag+的干扰。甲方案不严密,因为溶液可能为含有Ag+而不含SO42的无色溶液,当加入BaCl2溶液时同样可生成白色沉淀AgCl,再加稀硝酸,AgCl也不溶解;乙方案严密,因为只含有SO42的无色溶液才会出现此方案的现象。

练习册系列答案
相关题目