题目内容
某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验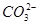 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果的准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸根离子能完全转化为沉淀。
其中正确的是
| A.①③ | B.②③ | C.②④ | D.①④ |
B
解析

练习册系列答案
相关题目
有4种金属a、b、c、d,它们与浓HNO3反应时,只有a不反应;往这4种金属粉末的混合物中加入盐酸,其中b、c溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到c离子的沉淀,则这4种金属的活动性强弱的顺序可能是
| A.c > b > d > a | B.b > a > d > c | C.a > b > c > d | D.d > c > b > a |
在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,问神秘的X不可能是( )
| A.FeCl3 | B.HNO3 | C.HCl | D.KNO3 |
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005 mol |
| B.0.010 mol |
| C.0.020 mol |
| D.0.030 mol |
下列事实不能用金属活动性解释的是
| A.生活中可用铝制的水壶烧水 |
| B.镀锌铁制品破损后,镀层仍能保护铁制品 |
| C.工业上常用热还原法冶炼铁,用电解法冶炼钠 |
| D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| | 操作 | 现象 | 结论 |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后呈红褐色 |
| D.只需滴加KSCN溶液 |
下列关于Na2CO3和NaHCO3性质的说法错误的是 ( )。
| A.热稳定性:NaHCO3<Na2CO3 |
| B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 |
| C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3 |
| D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3 |