题目内容
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuS04溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 . 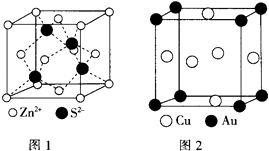
【答案】
(1)晶体
(2)1;1s22s22p63s23p63d9;深蓝色
(3)5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能
(4)4
(5)![]()
【解析】解:(1)晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,所以答案是:晶体;(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1 , 可以看出只有4S轨道上的电子未成对,二价铜离子的电子排布式为1s22s22p63s23p63d9 , 在CuS04溶液 中滴入过量氨水,形成配合物为[Cu(NH3)4]2+ , 为深蓝色,所以答案是:1;1s22s22p63s23p63d9;深蓝色;(3)(SCN)2分子结构式为N≡C﹣S﹣S﹣C≡N,1个N≡C键中有1个θ键,其余两个为π键,1mol(SCN)2分子中含有θ键的数目为5NA , 异硫氰酸(H﹣N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,所以答案是:5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;(4)根据图1,距离S2﹣最近的锌离子有4个,即S2﹣的配位数为4,所以答案是:4;(5)Cu原子位于晶胞面心,数目为6× ![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8× ![]() =1,晶胞体积V=(a×10﹣7)3 , 密度
=1,晶胞体积V=(a×10﹣7)3 , 密度 ![]() =
=  =
= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案