题目内容
【题目】Ⅰ.水的电离平衡线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
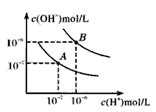
(1)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为 。
(2) 室温时将PH为5的硫酸溶液稀释500倍,稀释后溶液中,c(SO42-)和c(H+)之比约为 。
Ⅱ.今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是 (填序号)。
(2)当它们的物质的量浓度相同时,其pH最小是 (填序号)。
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为 (填序号)。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为 。
(5)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为 (填序号)。
【答案】Ⅰ(1)2:9(2)1:10
Ⅱ(1)①(2)③(3)①>②=③(4)1:1:2(5)①<②=③
【解析】
试题分析:Ⅰ(1)100℃时,将pH=8的Ba(OH)2溶液中:c(OH-)=10-4 mol/L,pH=5的稀盐酸中:c(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,混合溶液pH=7,溶液呈碱性,则溶液中氢氧根离子浓度为:10-12÷10-7=10-5 mol/L,则:c(OH-)=(10-4x-10-5y)÷(x+y)=10-5 mol/L,解得x:y=2:9,则Ba(OH)2与盐酸的体积比为2:9。
(2)pH=5的硫酸溶液中,c(H+)=10-5mol·L-1,c(SO42—)=5×10-6mol·L-1,将此溶液稀释500倍后,稀释液中c(SO42—)=1×10-8mol·L-1,而c(H+)趋近于1×10-7mol·L-1,则c(SO42—)∶c(H+)约为1∶10。
Ⅱ.(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L;需要②溶液浓度为1mol/L;、需要③H2SO4 溶液浓度为0.5mol/L,其物质的量浓度最大的是①;
(2)当它们的物质的量浓度相同时,假设浓度都是1mol/L;①CH3COOH溶液电离出氢离子浓度小于1mol/L、②HCl电离出氢离子浓度为1mol/L、③H2SO4,电离出的氢离子浓度为2mol/L;其pH最小的是③;
(3)加水稀释时,醋酸继续电离出氢离子,硫酸和HCl不再电离出氢离子,所以稀释100倍后,c(H+)由大到小的顺序是①>②=③;
(4)体积和物质的量浓度均相同的①②③三种酸溶液,醋酸和盐酸是一元酸,硫酸是二元酸,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为1:1:2。
(5)盐酸和硫酸是强酸,醋酸是弱酸,三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为①<②=③。

【题目】一定条件下,下列各组物质之间不能通过一步反应实现如图所示转化关系是
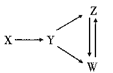
选项 | X | Y | Z | W |
A | Mg | Mg3N2 | MgCl2 | Mg(OH)2 |
B | Al | NaAlO2 | Al(OH)3 | AlCl3 |
C | N2 | HNO3 | NO | NO2 |
D | NaCl | Cl2 | HCl | HClO |
A. A B. B C. C D. D