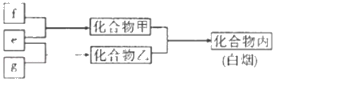
题目内容
【题目】室温下,将两种浓度均为![]() 的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.![]() 混合溶液(pH=10.30):
混合溶液(pH=10.30):![]()
B.氨水-NH4Cl混合溶液(pH=9.25):![]()
C.![]() 混合溶液(pH=4.76):
混合溶液(pH=4.76): ![]()
D.![]() 混合溶液(pH=1.68,H2C2O4为二元弱酸):
混合溶液(pH=1.68,H2C2O4为二元弱酸): ![]()
【答案】AD
【解析】
A. NaHCO3水溶液呈碱性,说明![]() 的水解程度大于其电离程度,等浓度的NaHCO3和Na2CO3水解关系为:
的水解程度大于其电离程度,等浓度的NaHCO3和Na2CO3水解关系为:![]() ,溶液中剩余微粒浓度关系为:
,溶液中剩余微粒浓度关系为:![]() ,
,![]() 和
和![]() 水解程度微弱,生成的OH-浓度较低,由NaHCO3和Na2CO3化学式可知,该混合溶液中Na+浓度最大,则混合溶液中微粒浓度大小关系为:
水解程度微弱,生成的OH-浓度较低,由NaHCO3和Na2CO3化学式可知,该混合溶液中Na+浓度最大,则混合溶液中微粒浓度大小关系为:![]() ,故A正确;
,故A正确;
B.该混合溶液中电荷守恒为:![]() ,物料守恒为:
,物料守恒为:![]() ,两式联立消去c(Cl-)可得:
,两式联立消去c(Cl-)可得:![]() ,故B错误;
,故B错误;
C.若不考虑溶液中相关微粒行为,则c(CH3COOH)=c(CH3COO-)=c(Na+),该溶液呈酸性,说明CH3COOH电离程度大于CH3COONa水解程度,则溶液中微粒浓度关系为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;
D.该混合溶液中物料守恒为:![]() ,电荷守恒为:
,电荷守恒为:![]() ,两式相加可得:
,两式相加可得:![]() ,故D正确;
,故D正确;
综上所述,浓度关系正确的是:AD。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目