题目内容
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。

通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。

请回答下列问题:
(1)步骤①②③中进行分离操作的名称是____,
(2)下列固体废料的成分中,不属于碱性氧化物的是____(填字母序号)。
a. TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由是____。

(4)滤液①中溶质的成分是____。
(5)步骤②中发生反应的离子方程式是 ___。
(6)将步骤③中制取分子筛的化学方程式补充完整:______
![]()
根据成分表中数据,计算10 kg固体废料,理论上应再加入Na2 Si03物质的量的计算式是n( Na2SiO3)=____mol(摩尔质量/g/mol :SiO2 60 Al2O3 102)。
【答案】 过滤 a、c 400℃钛的提取率太低,600℃钛的提取率提高不多,从节约能源,降低生产成本角度考虑,500℃最适宜 NaAlO2、Na2SiO3、NaOH Na2TiO3+2H+=H2TiO3+2Na+ 6 NaAlO2 10NaOH ![]()
【解析】(1)步骤①②③操作过后都得到滤渣和滤液,所以都是过滤操作。
(2)碱性氧化物是指能与酸反应生成盐和水的氧化物,题中TiO2和SiO2一般不与酸反应,所以选择a和c。
(3)从图像可以看出400℃钛的提取率太低,600℃钛的提取率提高不多,从节约能源,降低生产成本角度考虑,500℃最适宜。
(4)SiO2和Al2O3与过量NaOH反应的产物分别为Na2SiO3 和NaAlO2,故答案为NaAlO2、Na2SiO3、NaOH。
(5)步骤二是由于加入了稀盐酸使Na2TiO3转化为H2TiO3,Na2TiO3为固体,故答案为强酸制备弱酸的方程式Na2TiO3+2H+=H2TiO3+2Na+。
(6)根据元素守恒配平,答案为6 NaAlO2;10NaOH。根据上一问的方程式Na2SiO3 和NaAlO2的比应为1:1,根据图表的数据原料中NaAlO2的物质的量为2×10000×19.34%/102,Na2SiO3的物质的量为10000×5.39%/60,故需要加入的Na2SiO3的物质的量为两者的差值为![]() 。
。

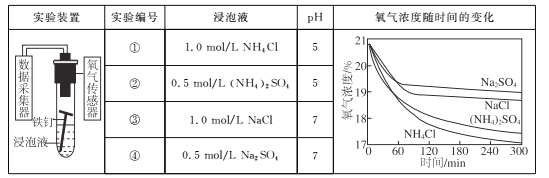
【题目】某学生为了探究影响化学反应速率的外界因素,进行以下实验。
(1)向100mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
①在0~1、1~2、2~3、3~4、4~5min各时间段中:
反应速率最大的时间段是________min,主要的原因可能是_____________________;
反应速率最小的时间段是________min,主要的原因可能是_____________________。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入________(填序号)。
a.蒸馏水 b.NaOH溶液 c.NaNO3溶液 d.Na2CO3溶液
(2)进行以下对比实验并记录实验现象。
实验 Ⅰ
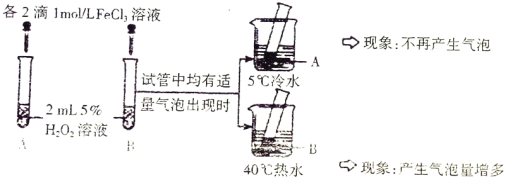
实验 Ⅱ:另取两支试管分别加入5mL5%eH2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡
产生。
①双氧水分解的化学方程式是________________。
②实验 Ⅰ 的目的是______________。
③实验 Ⅱ 未观察到预期现象,为了达到该实验的目的,可采取的改进措施是__________________。