题目内容
(2010?南通模拟)利用焦炭或天然气制取廉价的CO和H2,再用于有机合成是目前工业生产的重要途径.回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O═CO+3H2.部分物质的燃烧热数据如下表:
已知1mol H2O (g)转变为1mol H2O(l)时放出44.0kJ热量.则CH4和水蒸气在高温下反应生成1mol H2的反应热为
(2)用CO和H2在一定条件下合成甲醇:CO+2H2?CH3OH.工业上采用稍高的压强(5MPa)和250℃,其可能原因是
(3)1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2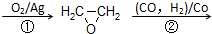 HOCH2CH2CHO
HOCH2CH2CHO 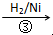 HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
CO+H2 CH4+H2O
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%.且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O═CO+3H2.部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
+68.7kJ/mol
+68.7kJ/mol
.(2)用CO和H2在一定条件下合成甲醇:CO+2H2?CH3OH.工业上采用稍高的压强(5MPa)和250℃,其可能原因是
从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率
从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率
.| 反应温度/℃ | 平衡常数 | 反应温度/℃ | 平衡常数 |
| 0 | 667.30 | 200 | 1.909×10-2 |
| 100 | 12.92 | 300 | 2.42×10-4 |
CH2=CH2
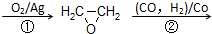 HOCH2CH2CHO
HOCH2CH2CHO 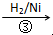 HOCH2CH2CH2OH
HOCH2CH2CH2OH某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
| ||
| ||
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%.且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
需要焦炭3.0 t、甲烷4.0 t
需要焦炭3.0 t、甲烷4.0 t
.分析:(1)①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
②CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
④H2O (g)=H2O(l)△H=-44.0kJ/mol,
由盖斯定律可知,③+④-①×3-②得CH4(g)+H2O(g)═CO(g)+3H2(g);
(2)由数据可知,温度越大,平衡常数越小及反应速率、压强对转化率的影响来分析;
(3)由给出的反应得出关系式C2H4 ~CO~H2 ~HOCH2CH2CHO及反应②、③所需的CO和H2可由以下两个反应来计算.
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
④H2O (g)=H2O(l)△H=-44.0kJ/mol,
由盖斯定律可知,③+④-①×3-②得CH4(g)+H2O(g)═CO(g)+3H2(g);
(2)由数据可知,温度越大,平衡常数越小及反应速率、压强对转化率的影响来分析;
(3)由给出的反应得出关系式C2H4 ~CO~H2 ~HOCH2CH2CHO及反应②、③所需的CO和H2可由以下两个反应来计算.
解答:解:(1)①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
②CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
④H2O (g)=H2O(l)△H=-44.0kJ/mol,
由盖斯定律可知,③+④-①×3-②得CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol,
则CH4和水蒸气在高温下反应生成1mol H2的反应热为
=+68.7kJ/mol,故答案为:+68.7kJ/mol;
(2)由数据可知,温度越大,平衡常数越小,从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率,
故答案为:从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率;
(3)反应②中 C2H4 ~CO~~~~~~~H2 ~~~HOCH2CH2CHO
28 28 2 74
2t m(CO)×80% m(H2)×80% m(HOCH2CH2CHO)
则m(CO)=14 t、m(H2)=1.0 t、m(HOCH2CH2CHO)=29.6t,
反应③中 HOCH2CH2CHO~H2
74 2
29.6t m(H2)×80%
则m(H2)=1.0t,
反应②、③中共需CO14 t、H22.0 t,
又C+H2O
CO+H2
12 28 2
m(C)
CH4+H2O
CO+3H2
16 28 6
m(CH4)
得方程
+
=14t和
+
=2.0t,
解得m(C)=3.0 t、m(CH4)=4.0t,
故答案为:需要焦炭3.0 t、甲烷4.0 t.
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
④H2O (g)=H2O(l)△H=-44.0kJ/mol,
由盖斯定律可知,③+④-①×3-②得CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol,
则CH4和水蒸气在高温下反应生成1mol H2的反应热为
| +206.1kJ/mol |
| 3 |
(2)由数据可知,温度越大,平衡常数越小,从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率,
故答案为:从平衡常数与温度的变化关系可知该反应为放热反应,温度低,甲醇的产率高,但反应速率慢,经济效益低;又因为该反应是气体体积缩小的反应,采用稍高的压强有利于提高原料气的转化率;
(3)反应②中 C2H4 ~CO~~~~~~~H2 ~~~HOCH2CH2CHO
28 28 2 74
2t m(CO)×80% m(H2)×80% m(HOCH2CH2CHO)
则m(CO)=14 t、m(H2)=1.0 t、m(HOCH2CH2CHO)=29.6t,
反应③中 HOCH2CH2CHO~H2
74 2
29.6t m(H2)×80%
则m(H2)=1.0t,
反应②、③中共需CO14 t、H22.0 t,
又C+H2O
| ||
12 28 2
m(C)
CH4+H2O
| ||
16 28 6
m(CH4)
得方程
| 28m(C) |
| 12 |
| 28m(CH4) |
| 16 |
| 2m(C) |
| 12 |
| 6m(CH4) |
| 16 |
解得m(C)=3.0 t、m(CH4)=4.0t,
故答案为:需要焦炭3.0 t、甲烷4.0 t.
点评:本题为综合题,考查知识点涉及盖斯定律计算、化学反应的计算、影响化学平衡和反应速率的因素,注重高考热点及知识的迁移应用,题目难度较大,尤其对于多个反应的计算,为学生解答的难点和易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目