题目内容
(1)将40 g NaOH配成2 L溶液,其物质的量浓度为 __________mol·L-1。(2)58.5 g NaCl配成1 L溶液,其物质的量浓度为__________ mol·L-1。
(3)标准状况下,22.4 L HCl配成0.5 L盐酸,其物质的量浓度为__________ mol·L-1。
(4)2 mol NaOH配成200 mL溶液,其物质的量浓度为__________mol·L-1。
(5)物质的量浓度为2 mol·L-1 的硫酸溶液500 mL,含硫酸的物质的量为__________mol。
(6)10mol HCl能配成__________L物质的量浓度为2 mol·L-1的盐酸。
(1)0.5 (2)1 (3)2 (4)10 (5)1 (6)5
![]()

练习册系列答案
相关题目
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 | 10℃ | 40℃ | 75℃ |
| 未溶固体 | 261 g | 175 g | 82 g |
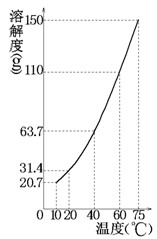
通过计算回答:
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)在什么温度将mg硝酸钾溶于ng水中恰好达到饱和状态?

 R(g) + 2L(?) ,此反应规律符合下图图像。
R(g) + 2L(?) ,此反应规律符合下图图像。
 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。