题目内容
乙二酸(HOOC-COOH)俗称草酸,具有还原性,用20ml 0.1mol/L的草酸溶液恰好将0.004mol的VO2+还原,而还原的产物VOn+中,n值为( )
| A、5 | B、4 | C、3 | D、2 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:草酸中C元素的化合价为+3价,则草酸被氧化只能生成二氧化碳气体;VO2+离子恰好将H2C2O4完全氧化成CO2,20ml 0.1mol/L的草酸溶液恰好将0.004mol的VO2+还原,则V元素的化合价降低,然后根据电子守恒列式计算出还原的产物VOn+中的n值.
解答:
解:VO2+离子恰好将H2C2O4完全氧化成CO2,则C元素的化合价由+3价升高为+4价,化合价升高了:4-3=1,
VO2+被还原为VOn+离子,VOn+离子中V元素的化合价为+(n+2),
则V元素的化合价由+5价降低+(n+2),降低的化合价为:(5-n-2),
由电子守恒可知:0.004mol×(5-n-2)=0.02L×0.1mol/L×2×1,
解得:n=2,
故选D.
VO2+被还原为VOn+离子,VOn+离子中V元素的化合价为+(n+2),
则V元素的化合价由+5价降低+(n+2),降低的化合价为:(5-n-2),
由电子守恒可知:0.004mol×(5-n-2)=0.02L×0.1mol/L×2×1,
解得:n=2,
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,题目难度中等,明确反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,利用电子守恒列式求算.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
能证明乙醇分子中有一个羟基的是( )
| A、乙醇完全燃烧生成CO2和H2O |
| B、乙醇能与水以任意比混溶 |
| C、0.1 mol乙醇与足量钠反应只能生成0.1 g氢气 |
| D、乙醇在铜催化下可被氧化 |
下列变化是物理变化的是( )
| A、将金属钠和金属钾混合研磨得到液体 |
| B、刚切开的金属钠放置在空气中变暗 |
| C、刚切开的金属钠放置在空气中加热变成淡黄色 |
| D、一小块钠投入到水中熔成闪亮的小球 |
Cl2是一种有毒气体,溶于水后形成的溶液能导电,则Cl2属于( )
| A、强电解质 |
| B、弱电解质 |
| C、非电解质 |
| D、既不是电解质也不是非电解质 |
鉴别稀硫酸和浓硫酸最简单的方法是( )
| A、加酚酞试液 |
| B、与铜片反应 |
| C、加BaCl2溶液和硝酸 |
| D、用玻璃棒各蘸一点滴在纸上 |
以下说法正确的是( )
| A、同温同压下,相同体积的任何物质,物质的量也相同 |
| B、0.5mol氢的质量是0.5g |
| C、0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
| D、同质量的H2和Cl2相比,H2所含的分子数多 |
下列叙述正确的是( )
| A、Fe分别与氯气和稀盐酸反应所得氯化物相同 |
| B、某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
| C、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| D、C、N、S三种单质直接与02反应都能生成两种氧化物 |
具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是( )
A、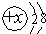 |
B、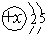 |
C、 |
D、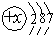 |