题目内容
(2011?湛江二模)25℃时下列叙述正确的是( )
分析:A、根据NH3?H2O属于弱电解质,电离呈碱性分析;
B、根据溶液的电荷守恒分析;
C、醋酸为弱酸,反应后醋酸过量,溶液呈酸性;
D、根据溶液的电荷守恒分析;
B、根据溶液的电荷守恒分析;
C、醋酸为弱酸,反应后醋酸过量,溶液呈酸性;
D、根据溶液的电荷守恒分析;
解答:解:A、氨水属于弱电解质,发生电离:NH3?H2O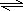 NH4++OH-,溶液呈碱性,则c(OH-)>c(H+),而溶液中还存在水的电离,则c(OH-)>c(NH4+),故A错误;
NH4++OH-,溶液呈碱性,则c(OH-)>c(H+),而溶液中还存在水的电离,则c(OH-)>c(NH4+),故A错误;
B、pH=2的HA酸溶液与pH=12的MOH碱溶液任意比混合,溶液呈电中性,根据电荷守恒可知:c(H+)+c(M+)=c(OH-)+c(A-),故B正确;
C、pH=4的醋酸与pH=10的NaOH溶液中c(OH-)=c(H+),因醋酸为弱酸,反应后醋酸过量,溶液呈酸性,则pH<7,故C错误;
D、pH=8的CH3COOH和CH3COONa的混合溶液中存在电荷守恒,则有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)因pH=8,则c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),故D正确.
故选BD.
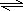 NH4++OH-,溶液呈碱性,则c(OH-)>c(H+),而溶液中还存在水的电离,则c(OH-)>c(NH4+),故A错误;
NH4++OH-,溶液呈碱性,则c(OH-)>c(H+),而溶液中还存在水的电离,则c(OH-)>c(NH4+),故A错误;B、pH=2的HA酸溶液与pH=12的MOH碱溶液任意比混合,溶液呈电中性,根据电荷守恒可知:c(H+)+c(M+)=c(OH-)+c(A-),故B正确;
C、pH=4的醋酸与pH=10的NaOH溶液中c(OH-)=c(H+),因醋酸为弱酸,反应后醋酸过量,溶液呈酸性,则pH<7,故C错误;
D、pH=8的CH3COOH和CH3COONa的混合溶液中存在电荷守恒,则有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)因pH=8,则c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),故D正确.
故选BD.
点评:本题考查离子浓度大小比较,题目难度中等,注意根据电荷守恒、质子守恒以及盐类水解的特点判断离子浓度的大小.

练习册系列答案
相关题目

 )溶液对环境进行消毒,能够有效消除霍乱病菌.下列有关过氧乙酸的叙述错误的是( )
)溶液对环境进行消毒,能够有效消除霍乱病菌.下列有关过氧乙酸的叙述错误的是( )