题目内容
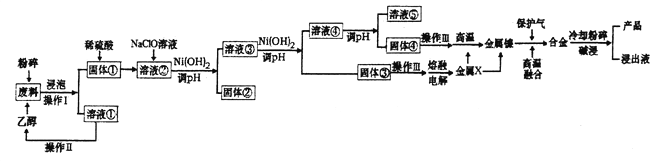
【题目】金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀。常温下,镍即可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),加热后它又会分解成金属镍和—氧化碳。工业上用含废镍废料(含有铝、铁和有机物)为原料制备兰尼镍的工艺流程如图所示:
已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为_________。
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为__________;实验室中在进行操作III时,仪器除酒精灯、坩埚、三脚架外还缺______________。
(3)加入NaC1O溶液时发生反应的离子反应方程式______________________________。
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为________________。
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=__________。
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因_________________________________。
【答案】 ad 蒸馏 坩埚钳、泥三角 ClO-+Fe2++2H+= Cl-+2Fe3++2H2O 1:1 1.8×1013 不能,因为冷却时,CO能与Ni反应生成四羰基镍
【解析】(1)a.铁坩埚与氢氧化钠不反应,可以用于熔融NaOH固体,正确;b.氧化铝能够与氢氧化钠在高温下反应,不能用于熔融NaOH固体,错误;c.石英的主要成分为二氧化硅,在高温下能够与氢氧化钠反应,不能用于熔融NaOH固体,错误;d.金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀,在高温下与氢氧化钠不反应,可以用于熔融NaOH固体,正确;故选ad;
(2)根据流程图,含废镍废料(含有铝、铁和有机物)用乙醇浸泡后得到的溶液①为乙醇和有机物的溶液,通过蒸馏可以分离乙醇和其他有机物;根据题目提示,实验室中在进行操作III时,用到酒精灯、坩埚、三脚架等仪器,应该是在坩埚中灼烧固体的操作,因此缺少的仪器有坩埚钳、泥三角,故答案为:蒸馏;坩埚钳、泥三角;
(3)固体①中含有镍、铝、铁,用硫酸溶解后生成Ni2+、Fe2+、Al3+,其中Fe2+能够被NaC1O溶液氧化生成Fe3+,反应的离子反应方程式为ClO-+Fe2++2H+= Cl-+2Fe3++2H2O,故答案为:ClO-+Fe2++2H+= Cl-+2Fe3++2H2O;
(4)固体④经操作III得到NiO。NiO与金属铝发生反应3NiO+ 2Al![]() 3Ni+ Al2O3,反应生成3mol Ni,需要2mol Al,高温融合得到的合金中铝和镍的物质的量之比为2:3,若Ni的物质的量为3mol,则反应中消耗的铝为2mol,合金中含有的铝为2mol,前后两份金属铝用量的最佳配比为2mol:2mol=1:1,故答案为:1:1;
3Ni+ Al2O3,反应生成3mol Ni,需要2mol Al,高温融合得到的合金中铝和镍的物质的量之比为2:3,若Ni的物质的量为3mol,则反应中消耗的铝为2mol,合金中含有的铝为2mol,前后两份金属铝用量的最佳配比为2mol:2mol=1:1,故答案为:1:1;
(5)25℃时,若测得溶液⑤pH=9,c(OH-)=10-5 mol/L,该溶液中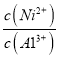 =
=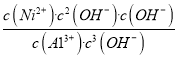 =
=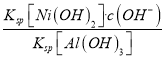 =
=![]() =1.8×1013,故答案为:1.8×1013。
=1.8×1013,故答案为:1.8×1013。
(6)常温下,镍可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),因此将金属铝与金属镍进行高温融合时,不能用CO做保护气,故答案为:不能,因为冷却时,CO能与Ni反应生成四羰基镍。

【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。