题目内容
【题目】已知高锰酸钾在常温下能与盐酸溶液反应,其反应的化学方程式如下:2KMnO4+16HC1=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥表示电子转移的方向和数目__________________________。
(2)上述反应中氧化剂是__________,氧化产物是__________。
(3)上述反应中氧化剂与还原剂的物质的量之比为__________。
(4)若反应中转移了0.6mol 电子,产生的气体在标准状况下的体积是__________。
【答案】 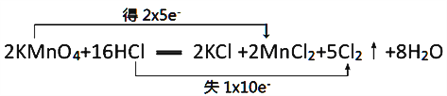 KMnO4 Cl2 1∶5 6.72L
KMnO4 Cl2 1∶5 6.72L
【解析】试题分析:本题考查双线桥分析氧化还原反应,氧化还原反应的有关概念和计算。
(1)用双线桥分析该反应: ,答案为:
,答案为: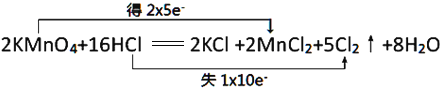 。
。
(2)Mn元素的化合价由KMnO4中+7价降至MnCl2中+2价,氧化剂为KMnO4。Cl元素的化合价由HCl中的-1价升至Cl2中的0价,Cl2为氧化产物。
(3)反应中参与反应的KMnO4为2mol,2molKMnO4都被还原;参与反应的HCl为16mol,其中10molHCl被氧化;氧化剂与还原剂物质的量之比为2:10=1:5。
(4)根据(1)中的分析,每转移10mol电子生成5molCl2,转移0.6mol电子生成0.3molCl2,生成的Cl2在标准状况下的体积为0.3mol![]() 22.4L/mol=6.72L。
22.4L/mol=6.72L。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目



