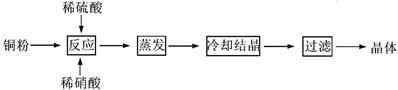
题目内容
下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液  混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) |
| B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba+)>c (Na+)> c (H+) |
| C.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
| D.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
D
试题分析:A正确,符合电荷守恒;B中,氢氧化钡是过量的,生成物是碳酸钡白色沉淀、氢氧化钠。由于剩余的氢氧化钡的物质的量大于生成的氢氧化钠的,B正确;根据水的电离方程式H2O
 H++OH-可知,溶液中氢离子和OH-浓度如果相等,对水电离的抑制程度是相同的,C正确;D不正确,是由于增大了醋酸根离子的浓度,抑制了醋酸的电离,而使pH升高的,答案选D。
H++OH-可知,溶液中氢离子和OH-浓度如果相等,对水电离的抑制程度是相同的,C正确;D不正确,是由于增大了醋酸根离子的浓度,抑制了醋酸的电离,而使pH升高的,答案选D。点评:在判断溶液中离子浓度大小时,关键是利用好几个守恒关系。即电荷守恒、物料守恒和质子守恒等。而在判断外界条件对电离平衡的影响时,需要注意利用勒夏特例原理进行判断。

练习册系列答案
相关题目