题目内容
【题目】一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为( ) 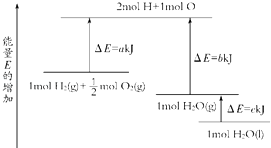
A.H2(g)+ ![]() O2(g)═H2O(g)△H=(a+b) kJmol﹣1
O2(g)═H2O(g)△H=(a+b) kJmol﹣1
B.2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJmol﹣1
C.H2(g)+ ![]() O2(g)═H2O(l)△H=(b+c﹣a) kJmol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJmol﹣1
D.2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJmol﹣1
【答案】D
【解析】解:由图中分析判断,1molH2(g)+ ![]() molO2(g)的能量为aKJ,1molH2O(g)的能量为bKJ,所以H2(g)+
molO2(g)的能量为aKJ,1molH2O(g)的能量为bKJ,所以H2(g)+ ![]() O2(g)═H2O(g)△H=(a﹣b) kJmol﹣1 , 1molH2O(g)转化为1molH2O(l)放热为cKJ,所以得到:H2(g)+
O2(g)═H2O(g)△H=(a﹣b) kJmol﹣1 , 1molH2O(g)转化为1molH2O(l)放热为cKJ,所以得到:H2(g)+ ![]() O2(g)═H2O(l)△H=(a﹣b﹣c) kJmol﹣1;
O2(g)═H2O(l)△H=(a﹣b﹣c) kJmol﹣1;
即2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJmol﹣1 ,
故选D.
根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态.

练习册系列答案
相关题目
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
试计算:
(1)混合物与盐酸反应的离子方程式
(2)盐酸的物质的量浓度;
(3)混合物中两物质的物质的量之比.