题目内容
【题目】已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-═2H2O+I2,且生成I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成I2完全消耗.由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝.因此,根据试剂X量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-═2H2O+I2反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 双氧水 | 0.1mol·L-1 稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。
实验2中m= ,n= 。
(2)一定温度下,H2O2+2H++2I-═2H2O+I2,反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为反应速率常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=__________min;
②根据上表数据可知,a、b的值依次为 和 。
(3)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是 。
【答案】(1)20.0;20.0
(2)①1.4 ②1;1
(3)便于控制反应温度;防止H2O2分解
【解析】
试题分析:(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。为控制变量,实验中盐酸的浓度应该相同,实验2中n=20.0 m=20.0;(2)根据公式v=k·c a(H2O2)·c b (I-)·c(H+),实验2与实验4的速率比为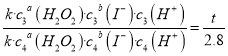 ,实验2与实验4的双氧水、碘化氢的浓度都相同,
,实验2与实验4的双氧水、碘化氢的浓度都相同,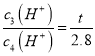 ,
,![]() ,t=1.4;根据实验1与实验2,a=1,根据实验,2与实验3,b=1;(3)H2O2易分解,温度不宜过高且采用水浴加热,便于控制反应温度,防止H2O2分解。
,t=1.4;根据实验1与实验2,a=1,根据实验,2与实验3,b=1;(3)H2O2易分解,温度不宜过高且采用水浴加热,便于控制反应温度,防止H2O2分解。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案