题目内容
【题目】同温同压下,m g甲气体和2m g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 甲与乙的相对分子质量之比为1∶1
B. 同温同压下,甲和乙的密度之比是1∶1
C. 同温同体积下,等质量的甲和乙的压强之比是1∶1
D. 等质量的甲和乙中的原子数之比是1∶1
【答案】D
【解析】
同温同压下,m g甲气体和2m g乙气体所占的体积之比为1:2,由n=![]() 可知甲乙两种气体的物质的量之比为1:2,结合n=
可知甲乙两种气体的物质的量之比为1:2,结合n=![]() =
=![]() 进行判断。
进行判断。
A.根据m=nM=![]() M知,二者的相对分子质量为1:1,选项A正确;
M知,二者的相对分子质量为1:1,选项A正确;
B.同温同压下,气体摩尔体积相同,m g甲气体和2m g乙气体所占的体积之比为1:2,根据ρ=![]() 知,其密度相同,选项B正确;
知,其密度相同,选项B正确;
C.根据PV=nRT=![]() RT知,同温同体积下等质量的甲和乙的压强之比等于其摩尔质量的反比,因为二者摩尔质量相同,所以压强相同,选项C正确;
RT知,同温同体积下等质量的甲和乙的压强之比等于其摩尔质量的反比,因为二者摩尔质量相同,所以压强相同,选项C正确;
D.等质量的两种气体的物质的量相同,但分子的构成未知,所以无法判断原子个数是否相同,选项D错误;
答案选D。

 阅读快车系列答案
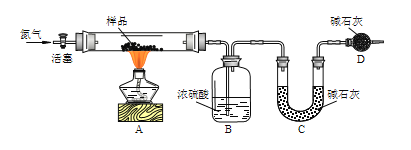
阅读快车系列答案【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
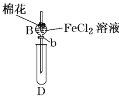
(1)棉花中浸润的溶液为____________,目的是____________________
(2)过程Ⅲ中一定发生反应的离子方程式为________________________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是______________________________________。
(3)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是___________________________。
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |