题目内容
8.下列有关实验操作或原理正确的是( )| A. | 用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 | |
| B. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| C. | 比较不同浓度硫酸与Na2S2O3反应的速率不能通过观察气泡逸出快慢比较,因为SO2易溶于水 | |
| D. | 通过测定等物质的量浓度的NaCl、Na2S溶液的pH,比较硫、氯两种元素的非金属性强弱 |
分析 A.剩余的金属钠应该放回原瓶;
B.氯水中HClO具有漂白性;
C.SO2易溶于水;
D.通过测定等物质的量浓度的NaCl、Na2S溶液的pH,能比较其氢化物的酸性强弱.
解答 解:A.用到金属钠时,要用镊子取,再用小刀切下所需量,剩余钠要放回原试剂瓶中,不能随意丢弃,故A错误;
B.氯水中HClO具有漂白性,则不能用pH试纸测定其pH,应利用pH计测定,故B错误;
C.SO2易溶于水,不能通过观察气泡逸出快慢比较,故C正确;
D.通过测定等物质的量浓度的NaCl、Na2S溶液的pH,能比较其氢化物的酸性强弱,但是不能确定硫、氯两种元素的非金属性强弱,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的保存、pH测定及非金属性比较等,侧重实技能及物质性质的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
19.下列有关说法或化学用语表示正确的是( )
| A. | ${\;}_{6}^{14}C$、${\;}_{7}^{14}N$互为同位素 | |
| B. | NH3的电子式: | |
| C. | 质量数为133、中子数为78的铯原子:${\;}_{78}^{133}Cs$ | |
| D. | ${\;}_{8}^{18}{O}^{2-}$的结构示意图: |
16.下列说法正确的是( )
| A. | 乙醇和乙酸都存在碳氧双键 | |
| B. | 乙烯可以与氢气发生加成反应,也可以发生自身加聚反应生成聚氯乙烯 | |
| C. | 高锰酸钾可以氧化苯和甲烷 | |
| D. | 甲烷和乙烯都可以与氧气反应 |
3.25℃,两种酸的电离平衡常数如下表.
下列叙述中正确的是( )
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-4 |
| H2B | 4.2×10-7 | 5.6×10-11 |
| A. | H2A的电离方程式:H2A?2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Kb1=$\frac{{K}_{w}}{4.2×1{0}^{-7}}$ | |
| C. | 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B) | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A═A2-+H2B |
13.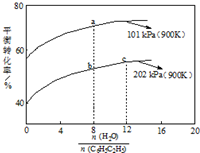 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )| A. | a、b两点转化率不等,但是化学平衡常数相等 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{3}$ | |
| C. | 恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 | |
| D. | b点和c点温度和压强相同,故其反应速率也相等 |
20.下列物质与危险化学品标志的对应关系正确的是( )
| A. |  氯化钠 | B. |  乙醇 | C. |  木炭 | D. |  氢氧化钠 |
17.在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氨气的平均速率:v(NH3)=0.3mol/(L•s),则2s末NH3的浓度为( )
| A. | 0.60 mol/L | B. | 0.50 mol/L | C. | 0.45 mol/L | D. | 0.55 mol/L |
18.历史上最早使用的还原性染料是靛蓝,其结构式为:下列关于它叙述中错误的是( )
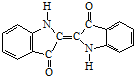

| A. | 它的化学式是C16H10N2O2 | B. | 它是高分子化合物 | ||
| C. | 它可以使溴水褪色 | D. | 它的苯环上的一氯取代产物有4种 |