题目内容
对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是
| A.增加某反应物的质量 | B.使用催化剂 |
| C.降低反应体系的压强 | D.升高温度 |
D
解析试题分析:A 只有增加的量能改变参加反应的物质的浓度,化学平衡才可能发生移动;B、使用催化剂,同等程度加快正逆反应速率,平衡不移动。 C.降低反应体系的压强,对反应前后气体体积不变的平衡,改变压强,平衡不移动;D.升高温度,平衡向吸热方向移动。所以答案D
考点:化学平衡的影响条件

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
一定条件下存在反应:2SO2(g)+O2 (g) 2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中正反应速率相同 |
| C.容器Ⅱ、中的反应达平衡时,SO3的体积分数:II > III |
| D.容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
下列说法不正确的是:
| A.能量较高、有可能发生有效碰撞的分子称为活化分子 |
| B.活化分子的平均能量与所有分子的平均能量之差称为活化能 |
| C.催化剂能参与反应,可降低原反应所需活化能 |
| D.非活化分子也有可能发生有效碰撞 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| B.容器Ⅰ、Ⅱ中正反应速率相同 |
| C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和大于1 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是
| A.反应达到平衡时, X的转化率为50% |
B.反应可表示为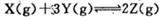 |
| C.增大压强可使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.参加反应的各物质的性质 | D.催化剂的加入 |
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
| 时间/min | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 | v(正)和v(逆)比较 |
| t0 | 6 | 0 | ? |
| t1 | 3 | 1 | v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是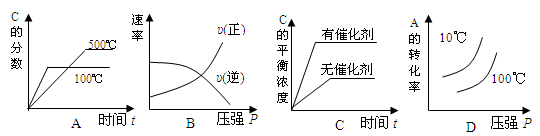
 C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )