题目内容
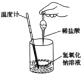
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
| A.该反应是吸热反应 |
| B.该反应是放热反应 |
| C.铁粉和硫粉在常温下可以发生反应 |
| D.硫化亚铁的总能量高于铁粉和硫粉的总能量 |
B
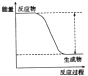
反应一发生即停止加热,反应仍可持续进行,这说明该反应是放热反应,即反应物的总能量高于生成物的总能量。所以正确的答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目