题目内容
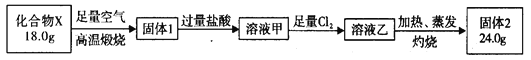
【题目】工业上用铝土矿(主要成分是Al2O3 , 还有少量的Fe2O3、SiO2提取冶炼铝的原料氧化铝.工艺流程如图:(每步所加试剂均稍过量) 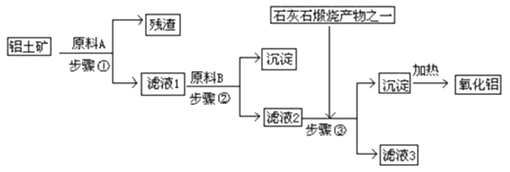
(1)步骤①中所得残渣的成分是(用化学式表示)、流程中分离固体和溶液的方 法是 , 所用到的玻璃仪器有烧杯、玻璃棒和 .
(2)步骤③中若加入过量的石灰石煅烧产物,则滤液3的成分是 , 该反应的 离子方程是: .
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化 铝的提取有什么影响 .
(4)实验室里常向AlCl3溶液中加入氨水来制取Al(OH)3 , 写出该反应的离子方程式 .
【答案】
(1)SiO2;过滤;漏斗
(2)碳酸氢钠;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
(3)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
(4)Al3++3NH3?H2O=Al(OH)3↓+3NH4+
【解析】解:(1)SiO2和盐酸不反应,Al2O3、Fe2O3均与盐酸反应,步骤①分离不溶固体与液体,为过滤操作,得到残渣为SiO2 , 过滤需要的玻璃仪器有漏斗、烧杯、玻璃棒;所以答案是:SiO2;过滤;漏斗;(2)滤液②含有AlO2﹣ , 步骤③通入过量的二氧化碳,与AlO2﹣反应生成的沉淀为氢氧化铝,反应进行方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 , 过滤沉淀得到的滤液主要成分为NaHCO3 , 离子方程式为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣; 所以答案是:碳酸氢钠;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质;所以答案是:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质;(4)向AlCl3溶液中加入氨水来制取Al(OH)3 , 反应的离子方程为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+ .

【题目】化学工业与人类的生产生活息息相关,回答下列问题:
已知反应: Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)写出 K 的表达式__________________。
(2)反应中的 a____________0(填“>”、“<”或“=”)。
(3)若 500℃时进行反应,CO2 起始浓度为 3molL-1,CO 的平衡浓度为______molL-1。
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值__________(填“增大”、“减小”或 “不变”)。
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)