题目内容
11.稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热.(1)实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热.请写出能表示该反应中和热的热化学方程式$\frac{1}{2}$Ba(OH)2(aq)+HCl (aq)═$\frac{1}{2}$BaCl2(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)分别取100mL 0.50mol/L盐酸与100mL 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃.
则实验测得的中和热△H=-56.8 kJ/mol(保留1位小数).
(3)如果用含1mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热小于57.3kJ(填“大于”、“小于”或“等于”);理由是醋酸的电离过程吸热.
分析 (1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据Q=m•c•△T计算;
(3)根据弱电解质电离吸热分析.
解答 解:(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀盐酸和氢氧化钡稀溶液都是强酸和强碱的稀溶液,则
反应的热化学方程式为$\frac{1}{2}$Ba(OH)2(aq)+HCl (aq)═$\frac{1}{2}$BaCl2(aq)+H2O△H=-57.3 kJ/mol,
故答案为:$\frac{1}{2}$Ba(OH)2(aq)+HCl (aq)═$\frac{1}{2}$BaCl2(aq)+H2O△H=-57.3 kJ/mol;
(2)100mL 0.50mol/L盐酸与100mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.1L×0.50mol=0.05mol,
溶液的质量为:200ml×1g/ml=200g,温度变化的值为△T=24.9℃-21.5℃=3.4℃,
则生成0.05mol水放出的热量为Q=m•c•△T=200g×4.18J/(g•℃)×3.4℃=2842.4J,即2.842kJ,
所以实验测得的中和热△H=-$\frac{2.842KJ}{0.05mol}$=-56.8 kJ/mol,
故答案为:-56.8 kJ/mol;
(3)醋酸为弱酸,电离过程为吸热过程,所以用含1mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:小于;醋酸的电离过程吸热.
点评 本题考查热化学方程式以及反应热的计算,题目难度中等,注意理解中和热的概念、把握热化学方程式的书写方法,以及利用化学方程式计算反应热等问题.

练习册系列答案
相关题目
1.常温常压下,24ml氢气和氧气的混合气体,点燃反应后再恢复到原来温度和压强.剩余气体体积为3ml,则原混合气体中氢气与氧气的分子个数比可能是( )
| A. | 1:16 | B. | 16:1 | C. | 17:7 | D. | 5:7 |
19.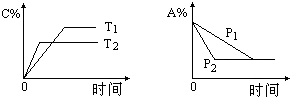 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
20.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟基(-OH)和氢氧根(OH-) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2?) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟甲基(-CH2OH)和甲氧基(CH3O-) |
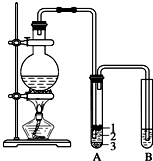 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:

 ,
, ,
, ;
; ,
, .
.