题目内容
【题目】实验室常用如下装置所示方法制备氯气:
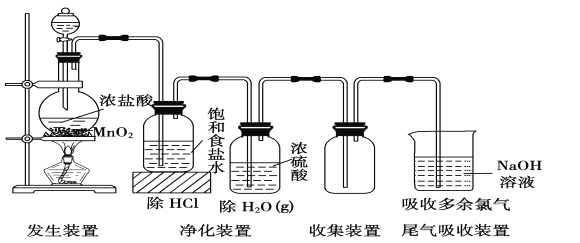
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是_________________;
(2)若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因____________________________________;
(3)若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是____________________________________。
【答案】浓盐酸挥发,稀盐酸不反应 2NaCl+2H2SO4+MnO2 MnSO4+Na2SO4+Cl2↑+2H2O 浓盐酸、浓硫酸
【解析】
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,浓盐酸易挥发,浓盐酸随着反应的进行会被稀释,当稀释到一定程度时就无法与氧化锰反应了,此时反应停止,故答案为:浓盐酸挥发,稀盐酸不反应。
(2)NaCl固体、浓硫酸和MnO2一起加热反应,反应的化学方程式为:2NaCl+2H2SO4+MnO2=MnSO4+Na2SO4+Cl2↑+2H2O,
故答案为:2NaCl+2H2SO4+MnO2=MnSO4+Na2SO4+Cl2↑+2H2O。
(3)浓HCl,本身就有挥发性,产生的是HCl气体,浓HCl挥发后变稀,由于浓硫酸有吸水性,稀HCl又变成浓HCl,所以加快了HCl的挥发速率,所以产生了均匀稳定干燥的氯化氢气流,所以分液漏斗和圆底烧瓶中应该盛放的试剂分别是浓盐酸、浓硫酸,故答案为:浓盐酸、浓硫酸。

 阅读快车系列答案
阅读快车系列答案【题目】已知:乙二酸俗称草酸(结构简式为HOOCCOOH,可简写为H2C2O4)。25℃时,草酸钙的Ksp=4.0×108,碳酸钙的Ksp=2.5×109。回答下列问题:
(1)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×104mol/L的草酸钾溶液20mL,能否产生沉淀________(填“能”或“不能”)。
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
I.实验前首先用浓度为0.1000molL1酸性KMnO4标准溶液滴定未知浓度的草酸。
①滴定过程中操作滴定管的图示正确的是________(填编号)。

②判断滴定终点的方法是:________。
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度__________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000molL1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温度 (℃) | 催化剂用量 (g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 | |
体积(mL) | 浓度(molL1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
b.实验1和3探究反应物浓度对该反应速率的影响;c.实验1和4探究催化剂对该反应速率的影响。 | |||||
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
④写出表中a对应的实验目的________;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2次 | 第3次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案______。






