题目内容
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为_____, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为______;C、D和E的第一电离能由大到小的顺序是______;C和D最高价含氧酸的酸性由弱到强的顺序为_________。CO![]() 中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为____________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为____________pm。

【答案】 ![]() 3s23p4 3︰1 NH3分子间可以形成氢键 Cl>S>P Cl>P>S H3PO4<H2SO4 sp3杂化 正四面体 [Cu(NH3)4]2+ NH3 4.6 129
3s23p4 3︰1 NH3分子间可以形成氢键 Cl>S>P Cl>P>S H3PO4<H2SO4 sp3杂化 正四面体 [Cu(NH3)4]2+ NH3 4.6 129![]()
【解析】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素,则A为氢元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍,则B为氮元素,C为磷元素; E元素原子核外电子有17种不同的运动状态,则E为氯元素,D和C同一周期且原子序数介于C与E之间,故D为硫元素;F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态,则F为铜元素。(1)B是氮元素,其原子的L层轨道2p轨道半充满的稳定状态,其表达式为![]() ;D为硫元素,其原子的价电子排布式是3s23p4;(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中有三个σ键和一个π键,比值为3:1;NH3分子间可以形成氢键,故NH3的沸点高于 同主族的其他氢化物的沸点;同周期元素从左而右电负性逐渐增强,故电负性由大到小的顺序为Cl>S>P;其中磷原子3p轨道为半充满稳定状态,第一电离能比同周期相邻原子的大,故第一电离能由大到小的顺序是:Cl>P>S;同周期元素从左到右非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,故酸性由弱到强的顺序为:H3PO4<H2SO4;CO43-离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体;(3)向CuSO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为[Cu(NH3)4]2+,该离子的配位体为NH3;(4)S(黑球)和Cu(白球)形成的某种晶体的晶胞如右图所示,一个晶胞中S位于晶胞的顶点和面心,Cu位于晶胞波内部,一个晶胞中含有S:8×
;D为硫元素,其原子的价电子排布式是3s23p4;(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中有三个σ键和一个π键,比值为3:1;NH3分子间可以形成氢键,故NH3的沸点高于 同主族的其他氢化物的沸点;同周期元素从左而右电负性逐渐增强,故电负性由大到小的顺序为Cl>S>P;其中磷原子3p轨道为半充满稳定状态,第一电离能比同周期相邻原子的大,故第一电离能由大到小的顺序是:Cl>P>S;同周期元素从左到右非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,故酸性由弱到强的顺序为:H3PO4<H2SO4;CO43-离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体;(3)向CuSO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为[Cu(NH3)4]2+,该离子的配位体为NH3;(4)S(黑球)和Cu(白球)形成的某种晶体的晶胞如右图所示,一个晶胞中S位于晶胞的顶点和面心,Cu位于晶胞波内部,一个晶胞中含有S:8×![]() +6×
+6×![]() =4个,含有4个Cu,即一个CuS晶胞含有4个S2-和4个Cu2+,晶胞的体积为(516×10-10 cm)3,则晶胞的密度为
=4个,含有4个Cu,即一个CuS晶胞含有4个S2-和4个Cu2+,晶胞的体积为(516×10-10 cm)3,则晶胞的密度为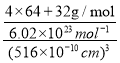 =4.6 g/cm3;四个Cu2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
=4.6 g/cm3;四个Cu2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为![]() a;
a; ![]() a,即可求出斜边为
a,即可求出斜边为![]() a(a 为晶胞边长),则a位置S2﹣离子与b位置Cu2+离子之间的距离为
a(a 为晶胞边长),则a位置S2﹣离子与b位置Cu2+离子之间的距离为![]() ×516pm=129
×516pm=129![]() pm。
pm。

 科学实验活动册系列答案
科学实验活动册系列答案



