题目内容
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:(1)上述转化过程中包含的反应类型有______(填序号)
A.置换反应B.化合反应C.分解反应D.复分解反应
(2)在反应②中,阳极的电极反应方程式为______;
(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为______;
(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡.平衡后混合气体的总物质的量为6mol,则甲的反应速率为______,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为______.
(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式:______;
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为______.
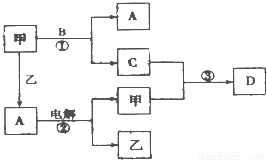
【答案】分析:A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,由转化关系可知,则甲为O2,乙为H2,A为H2O,B为NH3,反应①为氨气与氧气反应生成水和NO,则C为NO,所以D为NO2,
(1)反应①为4NH3+5O2 4NO+6H2O,反应②为2H2O
4NO+6H2O,反应②为2H2O 2H2↑+O2↑,反应③为2NO+O2═2NO2,以此分析反应类型;
2H2↑+O2↑,反应③为2NO+O2═2NO2,以此分析反应类型;
(2)反应②中阳极OH-失去电子;
(3)2H2+O2═2H2O~4e-,1mol电子转移,生成液态A时,放出142.9kJ的热量,则4mol电子转移,生成液态A时,放出142.9kJ×4=571.6kJ的热量;
(4)2NO+O2═2NO2,
开始 4 3 0
转化 2x x 2x
平衡4-2x 3-x 2x
平衡后混合气体的总物质的量为6mol,则4-2x+3-x+2x=6,以此计算;
平衡混合气体溶于水,恰好完全被水吸收,NO和二氧化氮、氧气恰好反应生成硝酸;
(5)①B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,为氢氧化亚铁、氢氧化铁;
②两种碱继续作用,得到Fe3O4,以此书写反应方程式.
解答:解:A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,由转化关系可知,则甲为O2,乙为H2,A为H2O,B为NH3,反应①为氨气与氧气反应生成水和NO,则C为NO,所以D为NO2,
(1)反应①为4NH3+5O2 4NO+6H2O为氧化还原反应,不属于置换反应,反应②为2H2O
4NO+6H2O为氧化还原反应,不属于置换反应,反应②为2H2O 2H2↑+O2↑,属于分解反应,反应③为2NO+O2═2NO2,属于化合反应,则包含的反应类型有BC,故答案为:BC;
2H2↑+O2↑,属于分解反应,反应③为2NO+O2═2NO2,属于化合反应,则包含的反应类型有BC,故答案为:BC;
(2)反应②中阳极OH-失去电子,电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)2H2+O2═2H2O~4e-,1mol电子转移,生成液态A时,放出142.9kJ的热量,则4mol电子转移,生成液态A时,放出142.9kJ×4=571.6kJ的热量,则热化学反应方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,故答案为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol;
(4)2NO+O2═2NO2,
开始 4 3 0
转化 2x x 2x
平衡4-2x 3-x 2x
平衡后混合气体的总物质的量为6mol,则4-2x+3-x+2x=6,解得x=1,则甲的反应速率为 =0.25mol/(L.min),
=0.25mol/(L.min),
平衡混合气体溶于水,恰好完全被水吸收,NO和二氧化氮、氧气恰好反应生成硝酸,该反应为NO+NO2+O2+H2O═HNO3,
故答案为:0.25mol/(L.min);NO+NO2+O2+H2O═HNO3;
(5)①B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,为氢氧化亚铁、氢氧化铁,离子反应为Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+,故答案为:Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+;
②两种碱继续作用,得到Fe3O4,反应方程式为Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O.
点评:本题考查无机物的推断,元素的推断是解答本题的关键,注意利用转化及D为红棕色气体分析,涉及知识点较多,考查较全面,题目难度中等.
(1)反应①为4NH3+5O2
 4NO+6H2O,反应②为2H2O
4NO+6H2O,反应②为2H2O 2H2↑+O2↑,反应③为2NO+O2═2NO2,以此分析反应类型;
2H2↑+O2↑,反应③为2NO+O2═2NO2,以此分析反应类型;(2)反应②中阳极OH-失去电子;
(3)2H2+O2═2H2O~4e-,1mol电子转移,生成液态A时,放出142.9kJ的热量,则4mol电子转移,生成液态A时,放出142.9kJ×4=571.6kJ的热量;
(4)2NO+O2═2NO2,
开始 4 3 0
转化 2x x 2x
平衡4-2x 3-x 2x
平衡后混合气体的总物质的量为6mol,则4-2x+3-x+2x=6,以此计算;
平衡混合气体溶于水,恰好完全被水吸收,NO和二氧化氮、氧气恰好反应生成硝酸;
(5)①B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,为氢氧化亚铁、氢氧化铁;
②两种碱继续作用,得到Fe3O4,以此书写反应方程式.
解答:解:A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,由转化关系可知,则甲为O2,乙为H2,A为H2O,B为NH3,反应①为氨气与氧气反应生成水和NO,则C为NO,所以D为NO2,
(1)反应①为4NH3+5O2
 4NO+6H2O为氧化还原反应,不属于置换反应,反应②为2H2O
4NO+6H2O为氧化还原反应,不属于置换反应,反应②为2H2O 2H2↑+O2↑,属于分解反应,反应③为2NO+O2═2NO2,属于化合反应,则包含的反应类型有BC,故答案为:BC;
2H2↑+O2↑,属于分解反应,反应③为2NO+O2═2NO2,属于化合反应,则包含的反应类型有BC,故答案为:BC;(2)反应②中阳极OH-失去电子,电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)2H2+O2═2H2O~4e-,1mol电子转移,生成液态A时,放出142.9kJ的热量,则4mol电子转移,生成液态A时,放出142.9kJ×4=571.6kJ的热量,则热化学反应方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,故答案为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol;
(4)2NO+O2═2NO2,
开始 4 3 0
转化 2x x 2x
平衡4-2x 3-x 2x
平衡后混合气体的总物质的量为6mol,则4-2x+3-x+2x=6,解得x=1,则甲的反应速率为
 =0.25mol/(L.min),
=0.25mol/(L.min),平衡混合气体溶于水,恰好完全被水吸收,NO和二氧化氮、氧气恰好反应生成硝酸,该反应为NO+NO2+O2+H2O═HNO3,
故答案为:0.25mol/(L.min);NO+NO2+O2+H2O═HNO3;
(5)①B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,为氢氧化亚铁、氢氧化铁,离子反应为Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+,故答案为:Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+;
②两种碱继续作用,得到Fe3O4,反应方程式为Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O.
点评:本题考查无机物的推断,元素的推断是解答本题的关键,注意利用转化及D为红棕色气体分析,涉及知识点较多,考查较全面,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
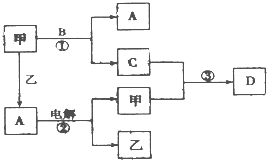 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:

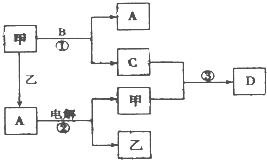 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系: