题目内容
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
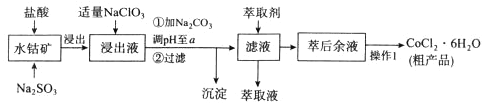
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
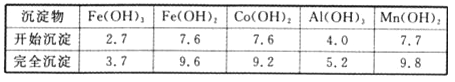
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCI2.6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式: 。
(2)写出NaClO3发生反应的主要离子方程式: ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式: 。
(3)惰性电极电解CoCl2溶液的阳极电极反应式为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
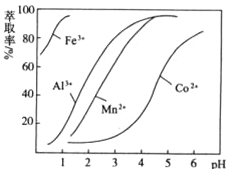
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是 ,其使用的最佳pH范围是 。
A.2.0~2.5 | B.3.0~3.5 |
C.4.0~4.5 | D.5.0~5.5 |
(6)力测定粗产品中CoCl2·H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
【答案】(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O。(2)ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3) 2Cl--2e-=Cl2↑(4)蒸发浓缩,冷却结晶;降低烘干温度,防止产品分解。
(5)除去锰离子 B(6)粗产品含有可溶性氯化物或晶体失去了部分结晶水
【解析】试题分析:(1)向水钴矿加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有氢离子,钴离子,亚铁离子,锰离子和铝离子等,所以氧化钴和亚硫酸钠在酸性条件下发生氧化还原反应,根据电荷守恒和得失电子守恒,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O。(2)氯酸钠的作用是将亚铁离子氧化成铁离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O..(3)电解氯化钴溶液时阳极是氯离子失去电子生成氯气,电极反应为:2Cl--2e-=Cl2↑(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作为蒸发浓缩,冷却结晶,过滤。根据题意知道氯化钴晶体常温下稳定无毒,加热到110~120℃,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的氯化钴晶体需减压烘干。(5)根据流程图分析,此时溶液中存在锰离子和钴离子,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0-3.5之间,可使锰离子完全沉淀,丙防止钴离子转化为氢氧化钴沉淀。(6)根据氯化钴晶体的组成分析,造成产品中氯化钴晶体的质量分数大于100%的原因可能是含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案