题目内容
把4种不同体积或不同浓度的X溶液,分别加入4个盛有10mL 2mol?L-1盐酸的烧杯中,并加水稀释到50mL,此时X和盐酸进行反应,其中反应速率最大的是( )
分析:加水稀释到50mL,最后体积相同,则选项中X的物质的量越大,其浓度越大,所以反应速率就越大,以此来解答.
解答:解:加水稀释到50mL,最后体积相同,则选项中X的物质的量越大,其浓度越大,所以反应速率就越大,
A.n(X)=0.02L×3mol/L=0.06mol;
B.n(X)=0.02L×2mol/L=0.04mol;
C.n(X)=0.01L×4mol/L=0.04mol;
D.n(X)=0.01L×2mol/L=0.02mol;
显然A的反应速率最大,故选A.
A.n(X)=0.02L×3mol/L=0.06mol;
B.n(X)=0.02L×2mol/L=0.04mol;
C.n(X)=0.01L×4mol/L=0.04mol;
D.n(X)=0.01L×2mol/L=0.02mol;
显然A的反应速率最大,故选A.
点评:本题考查化学反应的影响因素,明确浓度越大反应速率越大,注意最后体积相同,分析选项中的物质的量是解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) 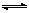 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线________(填:a或b)表示使用了催化剂;该反应属于________(填:吸热、放热)反应。
(2)下列说法正确的是________。
| A.起始充入的CO为1 mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1 mol CO和2 mol H2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
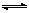 CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数________(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数________(填“增大”、“减小”或“不变”)。(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol又知H2O(l)=H2O(g) ΔH=+44 kJ/mol,请写出32 g的CH3OH(g)完全燃烧生成液态水的热化学方程式
______________________________________________________________________。
(6)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出用Co3+除去甲醇的离子方程式 。
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
 O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol (10分)对于两种相同的反应物,由于操作顺序不同,其反应过程不同,往往会导致不同的实验现象,有许多化学反应符合这一规律。例如碳酸钠溶液与稀盐酸滴加顺序不同反应现象不同就是一个典型。现有下列化学试剂:A、稀盐酸 B、氢氧化钠溶液 C、氯化铝溶液 D、偏铝酸钠溶液。选取其中的两种溶液,把一种溶液滴到另一种溶液中,其滴入溶液的体积与生成的沉淀的质量关系如上图所示。
(10分)对于两种相同的反应物,由于操作顺序不同,其反应过程不同,往往会导致不同的实验现象,有许多化学反应符合这一规律。例如碳酸钠溶液与稀盐酸滴加顺序不同反应现象不同就是一个典型。现有下列化学试剂:A、稀盐酸 B、氢氧化钠溶液 C、氯化铝溶液 D、偏铝酸钠溶液。选取其中的两种溶液,把一种溶液滴到另一种溶液中,其滴入溶液的体积与生成的沉淀的质量关系如上图所示。