题目内容
可逆反应 N2(g)+3H2(g)?2NH3(g),在500℃时,将2molN2 和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
分析:可逆反应不能进行到底,利用极限转化法计算出氨气的最大浓度即可解答.
解答:解:该反应为可逆反应,可逆反应不能进行到底.假设反应完全进行,由化学方程式 N2(g)+3H2(g)?2NH3(g),知2molN2 过量,因而2molH2 完全反应生成
mol NH3,故NH3的浓度肯定小于
=0.013mol/L,不可能达到0.15mol?L-1,故选D.
| 4 |
| 3 |
| ||
| 10L |
点评:本题考查可逆反应的特点,难度不大,掌握化学方程式相关的计算是解题的关键.

练习册系列答案
相关题目
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )
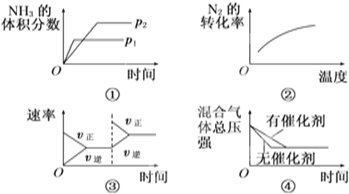

| A、①压强对反应的影响(p2>p1) | B、②温度对反应的影响 | C、③平衡体系增加N2对反应的影响 | D、④催化剂对反应的影响 |
 2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( )
2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( )