题目内容
15.下列叙述中,不能用平衡移动原理解释的是( )| A. | 高压的条件下,有利于工业上氨气的合成 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
分析 勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释.
解答 解:A、工业合成氨反应中,加压会向着生成氨气的方向进行,利于提高氨气的产率,能用勒夏特利原理解释,故A错误;
B、存在平衡2SO2+O2(g)?2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,故B错误;
C、由H2、I2(g)、HI(g)气体组成的平衡体系是一个前后气体系数和相等的体系,改变压强,化学平衡不会移动,不能用勒夏特利原理解释,故C正确;
D、存在Cl2+H2O?HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水光照后颜色变浅,能用勒夏特利原理解释,故D错误;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆过程,且平衡发生移动.

练习册系列答案
相关题目
6.判断在下列装置中电流表中没有电流产生的是( )
| A. |  | B. | 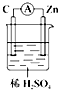 | C. | 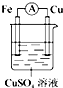 | D. | 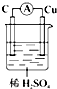 |
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,c(Cl-)>c( NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
20.用下列装置进行的相应实验能达到实验目的是( )

| A. | 图1装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
| D. | 图4装置用于除去碳酸氢钠固体中的少量碳酸钠 |
 ,
,
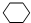 ,名称是环己烷.
,名称是环己烷.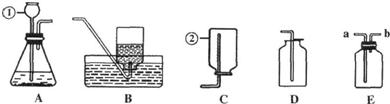

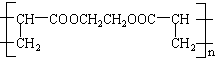 ,回答下列问题:
,回答下列问题: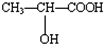 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$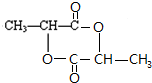 +2H2O.
+2H2O.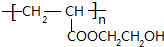 .
.