题目内容
7.下列实验方案不可行的是:BCEA.用品红溶液鉴别CO2和SO2气体 B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.用NH3和H2O做喷泉实验
E.所有剩余的药品都不能放回原瓶
F.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe SO4溶液液面以下.
分析 A.SO2气体能使品红溶液褪色;
B.铜与浓硝酸在常温下反应;
C.玻璃塞中二氧化硅与NaOH溶液发生反应生成硅酸钠;
D.NH3极易溶于H2O;
E.钠可以放回原瓶;
F.考虑氢氧化亚铁的不稳定性,易被氧化.
解答 解:A.因SO2气体能使品红溶液褪色,而CO2气体不能使品红溶液褪色,故A错误;
B.因铜与浓硝酸在常温下反应,所以不能用铜制容器盛放浓硝酸,故B正确;
C.因玻璃塞中二氧化硅与NaOH溶液发生反应生成硅酸钠,从而使玻璃塞和瓶口黏结在一起,所以放NaOH溶液的试剂瓶用橡皮塞,故C正确;
D.因NH3极易溶于H2O,所以NH3和H2O可做喷泉实验,故D错误;
E.因有些药品(如:钠等)用剩后要放回原瓶,故E正确;
F.氢氧化亚铁易被氧化,故把滴管插入FeSO4溶液液面下挤出溶液以制取Fe(OH)2,故F错误;
故选BCE.
点评 本题考查化学实验方案的评价,涉及物质的性质与应用等,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
17.下列各物质中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
18.C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第二周期,第ⅤA族,C元素的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)用“>”、“<”或“=”填空:
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途.高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为Al2O3•2SiO2•2H2O.
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目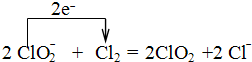 .
.
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为碳棒,电池负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O.
(1)N元素位于周期表第二周期,第ⅤA族,C元素的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)用“>”、“<”或“=”填空:
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| O2->Al3+ | 16O=18O | H2CO3<HNO3 | Fe<Al |
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
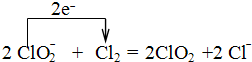 .
.(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为碳棒,电池负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O.
12.下列有关叙述中,正确的是( )
| A. | KClO3中Cl的化合价为+6价 | B. | NH3中N的化合价为-3价 | ||
| C. | CO2中C的化合价为+2价 | D. | H2O、H2O2中O的化合价都是-2价 |
17.钠与下列物质反应,产物唯一的是( )
| A. | 盐酸 | B. | 氯化铜溶液 | C. | Cl2 | D. | O2 |
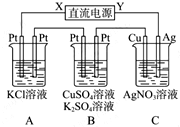 如图所示,若电解5 min时铜电极质量增加2.16g,试回答:
如图所示,若电解5 min时铜电极质量增加2.16g,试回答: