题目内容
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶解电解质的溶度积.已知下表数据:
|
B、混合溶液中加入氯水氧化亚铁离子为铁离子,调节溶液PH=3~4铁离子沉淀完全,过滤得到溶液是硫酸铜溶液、HCl溶液和H2SO4溶液;
C、Cu2+、Fe2+、Fe3+发生水解,因此它们的物质的量会减少;
D、由图表可知Fe3+在PH=3~4已经完全沉淀;
B、向该混合溶液中加入适量氯水,氯水氧化亚铁离子为铁离子,发生反应6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3,并调节溶液的pH为3~4,然后过滤,得到溶液是硫酸铜溶液、HCl溶液和H2SO4溶液,不能得到纯净的CuSO4溶液,故B错误;
C、等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液中设物质的量为1mol,n(SO42-)=5mol,n(Cu2+)+n(Fe2+)+n(Fe3+)=4mol,但Cu2+、Fe2+、Fe3+在水溶液中发生水解,所以该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4,故C正确;
D、由图表可知Fe3+在PH=3~4已经完全沉淀,所以PH=5的溶液中Fe3+不能大量存在,故D正确;
故选B.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
|
![]() KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
![]()
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
有关数据如下表:
|
| 熔点℃ | 沸点℃ | 密度(g/cm3) |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
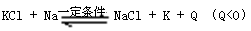
有关数据如下表:
|
|
熔点℃ |
沸点℃ |
密度(g/cm3) |
|
Na |
97.8 |
882.9 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
|
 KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
|
|
熔点℃ |
沸点℃ |
密度(g/cm3) |
|
Na |
97.8 |
882.9 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。