题目内容
【题目】下列单质或化合物性质的描述正确的是
A.Na2CO3的溶解性比NaHCO3小
B.SiO2与酸、碱均能反应,属于两性氧化物
C.FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu=2Fe2++Cu2+
D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3
【答案】C
【解析】
试题A、Na2CO3的溶解性比NaHCO3大,A错误;B、SiO2与是酸性氧化物 可以和减反应 而与HF反应是SiO2的一个特性,不是两性氧化物,B错误;C、FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu=2Fe2++Cu2+,C正确;D、铁和氯气反应只生成氯化铁,D错误。答案选C。

【题目】【加试题】乳酸亚铁:{[CH3CH(OH)COO]2Fe·3H2O,M=288.0g/mol}是一中新型的优良补铁剂,绿白色晶体,溶于水,几乎不溶于乙醇。某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成乳酸亚铁。
已知:
①几种金属离子生成氢氧化物沉淀的PH(开始沉淀的PH按金属离子浓度为1.0mol/L计算)。
金属离子 | 开始沉淀的PH | 沉淀完全的PH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
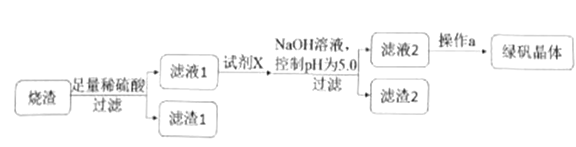
②研究性学习小组设计的由烧渣制备绿矾晶体的操作流程如下:
③由绿矾(FeSO4·7H2O)制备乳酸亚铁涉及下列反应:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
2CH3CH(OH)COOH+FeCO3+2H2O![]() [CH3CH(OH)COO]2Fe·3H2O+CO2↑。
[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
请回答:
(1)滤渣2的成分为__________(写化学式)。
(2)操作a为蒸发浓缩、冷却结晶、抽滤、洗涤、干燥。洗涤绿矾粗产品的具体操作为_______。
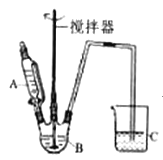
(3)据题干信息,欲制备较纯净的FeCO3时,某同学设计的实验装置示意图如图所示(夹持装置省略)。仪器A 中存放的试剂为________,装置C的作用为___________。
(4)在室温下,将所得的乳酸亚铁成品用无水乙醇进行浸泡2次,从而得到精制产品。选择用无水乙醇进行浸泡的优点是___________(写出两点)。
(5)该学习小组同学用KMnO4滴定法测定样品中Fe2+的量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________。
经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取0.576g样品,溶解后进行必要处理,用0.1000mol/L Ce(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/L Ce(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁的纯度为________(以质量分数表示)。