题目内容
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH= 。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。
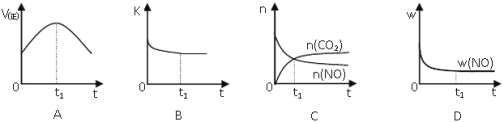
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H_0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为____________;
【答案】(1)4 (2分) (2)①D (1分)②不能(1分)
(3)C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1 (4)BD(2分)
(5)①C(s)+2NO(g)=CO2(g)+N2(g)②4(2分)<③80%(2分)
【解析】
试题分析:(1)根据溶液呈电中性可得c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),将溶液中已知离子的物质的量浓度代入上式,可得4×10-6+6×10-6+2×10-5+ c(H+)=2×4×10-5+3×10-5+2×10-5,解得c(H+)=1×10-4mol/L,所以溶液的pH=4;
(2)①A、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以混合气体的密度不再变化不能说明反应达到平衡状态,A错误;B、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量均是不变的,所以混合气体的平均分子量不再变化不能说明反应达到平衡状态,B错误;C、N2、O2、NO的物质的量之比为1∶1∶2不能说明正逆反应速率相等,反应不一定达到平衡状态,C错误;D.氧气的百分含量不再变化说明反应达到平衡状态,D正确,答案选D。
②2CO(g)=2C(s)+O2(g)△H>0,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;
(3)已知:①H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
②C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
根据盖斯定律可知②-①即得到焦炭与水蒸气反应的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1。
(4)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确;答案选BD;
(5)①从表中数据可知,碳、一氧化氮、E和F的化学计量数之比为0.04:0.08:0.08:0.08=1:2:1:1,则反应中碳被氧化,结合原子守恒可知,生成氮气和二氧化碳,且该反应是可逆反应,所以化学方程式 C+2NO![]() CO2+N2;
CO2+N2;
②平衡时二氧化氮和氮气的浓度均为0.04mol÷5L=0.008mol/L,一氧化碳的浓度为0.02mol÷5L=0.004mol/L,则平衡常数K1=0.008×0.008/0.0042=4;若T1<T2,根据表中数据可知升高温度反应物转化率减小,则该反应的△H<0。
③反应T1℃时达到化学平衡后再通入0.1molNO气体,根据方程式计算
C+ 2NO![]() CO2 + N2
CO2 + N2
起始物质的量 0.20 0 0
改变物质的量 2n n n
平衡时物质的量 0.2-2n n n
则平衡常数K=![]() ,解n=0.08mol,则转化率为
,解n=0.08mol,则转化率为![]() ×100%= 80%。
×100%= 80%。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】下列实验操作完全正确的是 ( )
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
C | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
D | 闻氯气的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
A. A B. B C. C D. D