题目内容
【题目】苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)△H
(1)已知:H2和CO的燃烧热(△H)分别为﹣285.8kJ.molL﹣1和﹣283.0kJ.molL﹣1;
C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(I)△H=+114.8kJmol﹣1
则制取苯乙烯反应的△H为
(2)向密闭容器中加入1mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ.下列说法正确的是 .
A.升高温度,正反应速率减小,逆反应速率增大
B.若继续加入1mol乙苯,苯乙烯转化率增大
C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,达平衡时反应能量变化为(△H﹣Q)kJ
(3)向2L密闭容器中加入1mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示.700℃时,乙苯的平衡转化率为 , 此温度下该反应的平衡常数为;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是 .
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2 , 该阳极的电极反应式为 , 若去除0.5mol苯乙烯,两极共收集气体mol.
【答案】
(1)+117.6KJ/mol
(2)D
(3)66.7%;![]() ;有机化合物在温度过高时分解
;有机化合物在温度过高时分解
(4)C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣;14
【解析】解:(1)H2和CO的燃烧热(△H)分别为﹣285.8kJ.molL﹣1和﹣283.0kJ.molL﹣1 , 可得热化学方程式:①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8KJ/mol,②CO(g)+
O2(g)=H2O(l)△H=﹣285.8KJ/mol,②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0KJ/mol,已知③:C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,根据盖斯定律,③+②﹣①可得:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol﹣283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,所以答案是:+117.6KJ/mol;(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1﹣a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H﹣Q)kJ,故D正确;所以答案是:BD;(3)参加反应的乙苯为xmol,则:
O2(g)=CO2(g)△H=﹣283.0KJ/mol,已知③:C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,根据盖斯定律,③+②﹣①可得:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol﹣283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,所以答案是:+117.6KJ/mol;(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1﹣a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H﹣Q)kJ,故D正确;所以答案是:BD;(3)参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1﹣x x x
由图示可知:700℃时,乙苯的物质的量百分含量为20%,则 ![]() =20%,所以x=
=20%,所以x= ![]() ,乙苯的平衡转化率为
,乙苯的平衡转化率为 ![]() ×100%=66.7%,
×100%=66.7%,
此温度下平衡常数K= ![]() =
= ![]() =
= ![]() ,
,
温度高于970℃时,苯乙烯的产率不再增加,可能有机物受热易分解是所致;
所以答案是:66.7%; ![]() ;有机化合物在温度过高时分解;(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH﹣ 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣ , 阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e﹣=H2↑+2OH﹣ ,
;有机化合物在温度过高时分解;(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH﹣ 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣ , 阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e﹣=H2↑+2OH﹣ ,
除去0.5mol苯乙烯,则:
C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣
0.5mol 20mol 4mol
2 H2O+2 e﹣=H2↑+2OH﹣
20mol 10mol
故两极共收集气体:4mol+10mol=14mol,
所以答案是:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣;14.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡的计算,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
【题目】Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol﹣1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素价电子层的电子排布式为 , 比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是 .
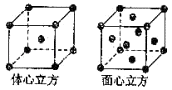
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 , 其中体心立方晶胞空间利用率为 .